1. INTRODUCCIÓN
Clostridium perfringens es un bacilo Gram positivo anaerobio, formador de endosporas, que se encuentra normalmente en suelos y aguas residuales y hace parte de la microbiota del intestino de humanos y animales. Este microorganismo es el agente causal de varias enfermedades humanas, incluyendo gangrena gaseosa y gastroenteritis de origen alimentario [1].
Aunque Escherichia coli es considerado el principal indicador de contaminación fecal, el agua potabilizada puede no contener esta bacteria y sin embargo estar contaminada con agentes infecciosos más resistentes a las condiciones del ambiente o a los tratamientos convencionales [2]. Mediante la formación de esporas, C. perfringens puede sobrevivir en ambientes no aptos para su desarrollo después de su deposición, lo cual facilita su detección a largo plazo. Debido a su asociación con el tracto digestivo de humanos y animales y la presencia de sus esporas en aguas residuales, C. perfringens ha sido identificado como un indicador de contaminación fecal tardía y lejana, por lo que puede señalar cuáles fuentes son susceptibles de contaminación intermitente [3]. Por la extraordinaria resistencia de sus esporas a los procesos de desinfección y a otras condiciones ambientales desfavorables, este microorganismo ha sido propuesto como índice de la presencia de protozoos y virus entéricos en aguas de consumo tratadas, siendo considerado particularmente como un buen sustituto para rastrear la presencia de ooquistes de Cryptosporidium en sistemas acuáticos [3, 4, 2]. Debido a que las esporas de C. perfringens son más pequeñas que los quistes u ooquistes de protozoos, estas pueden ser útiles como indicadores de la eficacia de los procesos de filtración [5, 2].
Desde el punto de vista de la calidad microbiológica del agua de consumo, no existe un límite inferior tolerable, por lo tanto, ésta debe estar libre de cualquier microorganismo potencialmente patógeno. Dado que los métodos para determinar la presencia de este tipo de microorganismos requieren en general de mucho tiempo y resultan costosos, usualmente se emplean ensayos para la determinación y cuantificación de indicadores en lugar de los patógenos.
A diferencia de la Directiva 98/83/CE del Consejo de la Unión Europea [6], la normatividad
colombiana actualmente no incluye a C. perfringens como indicador de contaminación fecal. Sin embargo, la Resolución 2115 de 2007 [6] establece que basados en el mapa de riesgo, las autoridades ambientales, con la colaboración de las autoridades sanitarias y las personas prestadoras de la jurisdicción, deben evaluar la posible presencia de otros microorganismos patógenos en el agua y la viabilidad de incorporarlos en el mapa de riesgo, señalando las acciones a seguir.
La normatividad colombiana para la evaluación de la calidad microbiológica del agua de consumo exige que los laboratorios implementen el Sistema de Gestión de la Calidad y la Acreditación de Pruebas de Ensayo [7] de metodologías validadas. En consecuencia, los laboratorios deben realizar la verificación de las metodologías a través de la evaluación de parámetros como precisión, exactitud, límite de detección e incertidumbre, con el fin de demostrar que son aptos para implementarlas bajo sus condiciones particulares de operación y que cumplen con los requisitos para el uso específico previsto.
Con el fin de aplicar métodos que garanticen resultados confiables, precisos y oportunos, el Grupo de Investigación en Gestión Modelación Ambiental GAIA, se propuso verificar la metodología microbiológica para la detección y cuantificación de C. perfringens en agua potable, de acuerdo a los criterios técnicos establecidos en la norma ISO 14189:2013, en la Guía Técnica Colombiana, GTC 84:2003 y en la NTC-ISO/IEC 17025: 2005 [8, 9, 10].
2. MATERIALES Y METODO
2.1 Materiales y Equipos
Para el procedimiento de verificación se tomó agua potable del sistema que surte las instalaciones del Grupo de Investigación en Gestión y Modelación Ambiental (GAIA). Se emplearon las cepas certificadas Clostridium perfringens NCTC 8237, Bacillus subtilis subesp. spizizenii ATCC 6633 y Clostridium bifermentans CECT 550. Para los cultivos se empleó agar TSC (triptosa-sulfitocycloserina) más suplemento selectivo para agar TSC y agar Columbia, marca Merck. Los cultivos se mantuvieron en jarras de anaerobiosis con reactivo Anaerocult A y tirillas Anaerotest, marca Merck. La prueba confirmativa se realizó con 1- Revista Politécnica ISSN 1900‐2351 (Impreso), ISSN 2256‐5353 (En línea), Año 12, Número 23, páginas 83‐89, Julio – Diciembre 2016 85 naphthylphosphate disodium salt y Fast Blue B Salt, marca Sigma. Se emplearon filtros de nitrocelulosa estériles con poro de 0,45 µm y 47 mm de diámetro.
La filtración se realizó con bomba de vacío conectada a un sistema multicanal de acero inoxidable y portafiltros estériles. Todo el procedimiento se llevó a cabo en una cámara de flujo laminar vertical marca Esco y para los cultivos se empleó una incubadora marca Binder.
2.2 Desarrollo del método
El procedimiento de verificación se realizó con base en la metodología establecida en la Norma ISO 14189:2013 para la enumeración de Clostridium perfringens, empleando el método de Filtración por Membrana [8] (Figura 1).
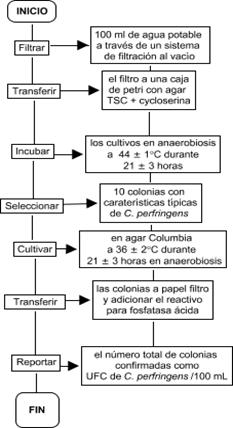
Fig.1. Procedimiento para la detección y cuantificación de Clostridium perfringens según la norma ISO 14189:2013.
2.3 Verificación de la metodología
Se seleccionó la dilución de trabajo y se evaluaron los parámetros de verificación: límites de detección y cuantificación, precisión, exactitud e incertidumbre.
2.3.1 Límite de detección
El límite de detección se calculó a partir de la fórmula 1 [9]:
P(+) = 1 – e –m (1)
Donde,
e: Es la base de logaritmo natural
m: en el número promedio de partículas por porción
analítica.
Para el cálculo del límite de detección, usando la cepa Clostridium perfringens NCTC 8237 se prepararon diluciones decimales hasta 10-9 y se identificó el rango donde se pueden obtener recuentos confiables (de acuerdo a las limitaciones del método) y se analizaron por triplicado.
2.3.2 Precisión
Fue determinada como repetibilidad y precisión intermedia. Para su cálculo, los resultados de los recuentos se linealizaron (Log10).
Para evaluar la repetibilidad, se determinó el coeficiente de variación (% CV) de los ensayos para una muestra preparada, a una dilución de trabajo definida, para dicha muestra se analizaron 12 repeticiones.
%
CV=![]() X100
(2)
X100
(2)
Donde s, es la desviación estándar del
conjunto de medidas y ![]() es el promedio de los
datos.
es el promedio de los
datos.
Para la precisión intermedia, otro analista repitió el mismo procedimiento de preparación de muestras y de análisis. A partir de los resultados obtenidos por el analista responsable de la verificación y el segundo analista, se evaluó la precisión intermedia del método, mediante el cálculo del CV.
El porcentaje de repetibilidad (% R) y de precisión intermedia (% PI) se calculó mediante la fórmula 3.
% R y % PI = (100 - CV) (3
![]()
2.3.3. Exactitud.
La exactitud se evaluó con la cepa de referencia Clostridium perfringens NCTC 8237, mediante el análisis de tres diluciones (10-6, 10-7 y 10-8) con 12 repeticiones cada una. Los ensayos se realizaron en paralelo en dos matrices diferentes, agua potable y agua peptonada.
Como control para verificar la ausencia del microorganismo indicador, se analizó por triplicado el agua potable sin inocular
El porcentaje de recuperación (% R) para agua potable se calculó con la fórmula 4.
% R = (![]() muestra inoculada)/(
muestra inoculada)/(![]() cepa +
cepa +![]() muestra) x 100 (4)
muestra) x 100 (4)
Donde ![]() es el promedio de la
concentración.
es el promedio de la
concentración.
2.3.4. Incertidumbre
La incertidumbre del método se estimó de acuerdo con los lineamientos de la norma ISO 29201:2012 [10]. Como factores de aporte significativo a la incertidumbre del resultado final se consideraron la precisión intermedia, la temperatura de incubación, el volumen de muestra y los recuentos presuntivos y confirmados de unidades formadoras de colonias.
La incertidumbre estándar relativa al componente
aleatorio se estimó con la fórmula 5:
![]() (5)
(5)
Donde SR corresponde a la desviación estándar del conjunto de datos encontrados por los analistas y n es el número total de datos procesados.
La incertidumbre relativa combinada se estimó mediante la raíz cuadrada de la suma de los cuadrados de la incertidumbre estándar relativa al componente aleatorio y de las incertidumbres asociadas al componente sistemático (ecuación 6).
![]() A1)2 +
A1)2 + ![]() B)2 +
B)2 + ![]() C)2 +
C)2 + ![]() D)2 (6)
D)2 (6)
Donde µA1 es la incertidumbre estándar relativa al componente aleatorio, µB corresponde a la temperatura de incubación de la prueba presuntiva, µC corresponde a temperatura de incubación de la prueba confirmativa y µD corresponde al volumen de la muestra.
La incertidumbre combinada de los resultados experimentales se estima mediante la ecuación 7.
µore ![]() comb)2 + (µd op)2 (7)
comb)2 + (µd op)2 (7)
Donde, µ comb es la incertidumbre relativa combinada bajo condiciones de reproducibilidad intermedia.
µd op es la incertidumbre operacional relativa intrínseca al resultado experimental, que está dada por la fórmula 8.
![]() (8)
(8)
Donde nc es el número total de colonias presuntivas contadas, nz es el número total de colonias aisladas para confirmación y nk es el número de colonias confirmadas.
Para estimar la incertidumbre expandida se usó un factor de cobertura K = 2 con un nivel de confianza del 95% (ecuación 9).
![]() µE = (
µE = ( ![]() comb)2 - (µd op)2 )*(2)
(9)
comb)2 - (µd op)2 )*(2)
(9)
Donde µcomb es la incertidumbre relativa combinada, y µd op es la incertidumbre operacional.
2.3.5. Tratamiento estadístico de los datos
Se llevó a cabo el análisis descriptivo de estimación de coeficientes de variación, promedios y desviaciones estándar. Adicionalmente, para evaluar si existen diferencias significativas entre las medias de los analistas, se realizó un Análisis de Varianza de un Factor y se determinaron los valores F y F crítico. Estos análisis se realizaron
utilizando las herramientas del programa Microsoft Excel.
3. RESULTADOS
El recuento de Clostridium perfringens NCTC 8237 fue posible en las diluciones 10-6 y 10-7. En concentraciones mayores, se presenta ennegrecimiento del medio, lo cual dificulta las lecturas (Tabla 1).
Tabla 1. Resultados de los recuentos UFC/mL de Clostridium perfringens en diluciones evaluadas por triplicado.
|
DILUCIÓN |
Resultado 1 |
Resultado 2 |
Resultado 3 |
PROMEDIO |
|
1 x 10 -5 |
Incontable |
Incontable |
Incontable |
- |
|
1 x 10-6 |
184 |
210 |
220 |
204,7 |
|
1 x 10-7 |
19 |
22 |
25 |
21 |
|
1 x 10-8 |
0 |
0 |
0 |
0 |
Con estos resultados se establecieron las concentraciones de trabajo para determinar el límite de detección, la precisión, la exactitud y el porcentaje de recuperación.
El límite de detección del método de Filtración por Membrana para Clostridium perfringens se presenta en la dilución 10-7, ya que a 10-8 la probabilidad de detección es menor al 95% [9] (Tabla 2).
Tabla 2. Límite de detección del método para la determinación y cuantificación de Clostridium perfringens NCTC 8237.
|
Dilución |
Clostridium perfringens |
|
|
Promedio |
P(+) = 1 – e -m |
|
|
1 x 10-6 |
204, 7 |
1 |
|
1 x 10-7 |
21 |
0,99 |
|
1 x 10-8 |
0 |
0,00 |
De acuerdo con los resultados (Tabla 3), los porcentajes de repetibilidad de los analistas 1 y 2 fueron de 96,54 % y 97,52 %, respectivamente, para la detección y cuantificación de Clostridium perfringens en agua potable por el método de Filtración por Membrana.
Tabla 3. Repetibilidad de los ensayos realizados por los analistas 1 y 2.
|
Analista |
1 |
2 |
|
Media |
7,82 |
7,80 |
|
Desviación estándar |
0,27 |
0,19 |
|
Coeficiente de variación (%) |
3,46 |
2,47 |
La precisión intermedia calculada para los analistas 1 y 2 en este ensayo fue del 97,72 % (Tabla 4). El análisis de varianza de un factor para el recuento UFC/100mL de Clostridium perfringens en 12 repeticiones para cada uno de los analistas arrojó un valor de F menor que el F crítico, lo cual significa que se acepta la igualdad de medias, es decir, no existen diferencias significativas entre los analistas 1 y 2.
Tabla 4. Precisión intermedia del ensayo realizado por los analistas 1 y 2.
|
Función estadística |
Resultado |
|
Media |
7,84 |
|
Desviación estándar |
0,18 |
|
Coeficiente de variación (%) |
2,28 |
La recuperación de Clostridium perfringens NCTC8237 fue de 99,61% en la dilución 10-6 y de 92,49% en la dilución 10-7 (tabla 5).
Tabla 5. Porcentajes de recuperación de Clostridium perfringens NCTC 8237.
|
Dilución |
Media |
Desviación estándar |
Coeficiente de variación (%) |
Porcentaje de recuperación |
|
10-6 |
2,51 |
0,07 |
2,94 |
99,61 |
|
10-7 |
1,50 |
0,10 |
6,42 |
92,49 |
Aplicando la metodología ISO 14189:2013 para la determinación y cuantificación de Clostridium perfringens, la incertidumbre relativa combinada del laboratorio se estimó como µ comb = 0,0375, la incertidumbre operacional intrínseca al resultado experimental fue µd op = 0,1062 y el valor de la incertidumbre expandida fue µE = 0,2252.
4. DISCUSIÓN
La verificación de un método analítico permite evaluar sus características y determinar si estas cumplen o no los requisitos previamente establecidos, igualmente, permite evaluar la capacidad técnica de cada laboratorio de ensayo en particular. Por esta razón, verificar metodologías de análisis microbiológico es prioritario para garantizar la oferta de servicios oportunos y confiables.
En el desarrollo de esta verificación, las diluciones de trabajo para el cálculo de la repetibilidad y del porcentaje de recuperación estuvieron dentro de los rangos óptimos y aceptables para recuentos por medio del método de Filtración por Membrana, teniendo en cuenta la sobredispersión de los microorganismos [11].
La repetibilidad y la precisión intermedia obtenidas en este ensayo se ajustan a valores guía reportados en los anexos de la norma ISO 14189:2013 [8], indicando que el método es repetible bajo las mismas condiciones de ensayo. De igual forma, los porcentajes de recuperación para determinar la exactitud del método fueron superiores al criterio de aceptación de referencia (>72%) [8], indicando que el método de Filtración por Membrana para la detección y cuantificación de Clostridium perfringens en agua potable, aplicado bajo las condiciones del laboratorio GAIA, es exacto.
La incertidumbre expandida que se estimó en este trabajo es específica para los resultados de la verificación realizada. La estimación de este parámetro es particularmente relevante cuando la incertidumbre afecta el cumplimiento con los límites de una especificación [9].
5. CONCLUSIón
La metodología para la detección y cuantificación de Clostridium perfringens en agua potable aplicada en el laboratorio GAIA, arroja resultados confiables, precisos y exactos de acuerdo con los criterios de aceptación establecidos a través de la determinación del límite de detección, precisión y exactitud. La estimación de la incertidumbre permite el cumplimiento de requisitos específicos de la norma ISO/IEC 17025 para laboratorios de ensayo que buscan la acreditación de métodos cuantitativos.
6. AGRADECIMIENTOS
Los autores agradecen a la Universidad de Antioquia y a Colciencias por el soporte financiero al proyecto código 111556136074: “Validación y acreditación de la metodología de filtración por membrana para la determinación de Legionella sp. y Clostridium sp. en una matriz de agua potable para el Grupo de Investigación en Gestión y Modelación Ambiental - GAIA”, en el marco de la convocatoria 561 de 2012.
7. Referencias Bibliográficas
[1] Yonogi, S., Matsuda, S., Kawai, T., Yoda, T., Harada, T., Kumeda, Y., Gotoh, K., Hiyoshi, H., Nakamura, S., Kodama, T. y Iidab, T. BEC, a Novel Enterotoxin of Clostridium perfringens Found in Human Clinical Isolates from Acute Gastroenteritis Outbreaks, Infection and Immunity, 82, 2390–2399, 2014.
[2] Organización Mundial de la Salud, OMS. Guías para la calidad del agua potable. Primer apéndice a la tercera edición. Volumen 1. 2006.
[3] Mueller-Spitz, S.R., Stewart, L.B., Val Klump, J. y McLellan, S.L. Freshwater Suspended Sediments and Sewage Are Reservoirs for Enterotoxin-Positive Clostridium perfringens, Appl. Environ. Microbiol., 76 5556–5562, 2010.
[4] Clapham, D. y Franklin, N. Cryptosporidium and Giardia lamblia in private water supplies. Environ. Health J, 106 164-169, 1998.
[5]. Payment, P., Waite, M. y Dufour A. Introducing parameters for the assessment of drinking wáter quality. En: Assessing Microbial Safety of Drinking Water Improving Approaches and Methods: Improving Approaches and Methods. (Eds. A. Dufour, M. Snozzi, W. Koster, J. Bartram, E. Ronchi y L. Fewtrell), WHO Drinking Water Quality Series, OECD—WHO, IWA Publishing, 47-77, 2003.
[6] DIRECTIVA 98/83/CE DEL CONSEJO de 3 de noviembre de 1998 relativa a la calidad de las aguas destinadas al consumo humano.
[7] República de Colombia. Características, instrumentos básicos y frecuencias del sistema de control y vigilancia para la calidad del agua para Revista Politécnica ISSN 1900‐2351 (Impreso), SSN 2256‐5353 (En línea), Año 12, Número 23, áginas 83‐89, Julio – Diciembre 201689 consumo humano. Ministerio de la Protección Social, Ministerio de Ambiente, Vivienda y Desarrollo Territorial. Resolución 2115 de 22 de junio de 2007. Bogotá. 2007.
[8] International Standards Organization, ISO. Calidad del Agua – Enumeración de Clostridium perfringens, empleando el método de Filtración por Membrana. Norma 14189:2013.
[9] Norma Técnica Colombiana. Requisitos generales para la competencia de los laboratorios de ensayo y calibración. NTC-ISO/IEC 17025. ICONTEC. Ed 2005. 2005
[10] Guidance on Validation of Microbiological Methods. Calidad del agua. Guía para la orientación acerca de la validación de métodos de análisis microbiológicos. Adopción idéntica (IDT) por traducción de la ISO/TR 13843:2000 Water Quality. GTC 84 2003.
[11] International Standards Organization, ISO. Water quality. The variability of test results and the uncertainty of measurement of microbiological enumeration methods. Norma ISO 29201:2012.
[12] Criterios para la validación de los métodos de ensayos físico-químicos y microbiológicos. En: Guía para el funcionamiento de los laboratorios de ensayo de aguas. (Ed. Morillas, P.P.). Asociación española de abastecimientos de agua y saneamiento. 2012. Disponible en: http://www.aeas.es/documentos/guiafuncionamient olaboratoriosensayoaguas2.pdf [consultado el 8 de agosto de 2015].