1. INTRODUCCIÓN
El control de la potabilidad del agua es de gran importancia, debido a que su calidad influye directamente en la salud, el agua es uno de los recursos naturales fundamentales y se considera de buena calidad cuando está exenta de sustancias y microorganismos que causen enfermedades a los seres vivos [1]. En el agua proveniente de desechos domésticos y en aguas superficiales suele encontrarse nitratos en pequeñas cantidades, pero en efluentes de plantas de tratamiento biológico y en aguas subterráneas pueden alcanzar altas concentraciones cuando la lluvia o agua de irrigación lleva el nitrato a través del suelo hasta las aguas subterráneas. Tales concentraciones de nitratos provienen de fertilizantes, estiércol o residuos líquidos que se liberan de los tanques sépticos, adicional al nitrato producido en forma natural a partir de nitrógeno por efecto de bacterias presentes en el suelo. El análisis cuantitativo de nitratos en el agua es importante ya que dependiendo de su concentración puede llegar a causar problemas de salud, como el mal conocido como “metahemoglobinemia infantil”, que se da cuando la molécula de hemoglobina se oxida disminuyendo su capacidad de transportar oxígeno [2], [3]. La reglamentación Colombiana especifica un límite máximo aceptable de 10 mg NO3/L (equivalentes a 2.258 mg NO3- -N/L) en aguas para consumo humano [4].
Uno de los métodos más utilizados para la cuantificación de nitratos es el método de Reducción cadmio-cobre [5], [6] que utiliza una columna de vidrio donde se filtra la muestra a analizar a través de gránulos de cadmio tratados con sulfato de cobre. En presencia del cadmio, el nitrato (NO3–) se reduce a nitrito (NO2–) y este se determina por diazotación con sulfanilamida y diclorhidrato de N-(1-naftil)-etilendiamina (formación de un tinte “azo” altamente coloreado) que es fácilmente cuantificable en un espectrofotómetro Uv-Vis. El intervalo de aplicación reportado para este método es de 0.01 a 1.0 mg NO3- -N/L [5], [6]. Si bien el método de Reducción cadmio-cobre resulta efectivo para la cuantificación de nitratos en agua, presenta algunas desventajas como: i) los riesgos asociados al uso de cadmio, por ser una sustancia altamente tóxica por inhalación aún en pequeñas concentraciones y que además puede causar cáncer y afectar la fertilidad [7]; ii) requiere un relativo alto consumo de reactivos; iii) presenta un limitado rango de calibración lineal y, iv) demanda largo tiempo para su aplicación ya que. cada análisis requiere preparar la columna, realizar curvas de calibración, preparar estándares y tratar o procesar las muestras antes y después de su filtración a través de la columna [7].
En contraste, existen métodos como el Ion selectivo, los cuales se comercializan como “equipos inteligentes” que a través de sondas pueden reconocer automáticamente el parámetro de prueba, el historial de calibración y el método. Para el caso de la cuantificación de nitratos, la sonda consiste en una semi-pila de iones específicos y una referencia de celda media. La relación entre el potencial medido y la concentración de iones en la solución se expresa mediante la Ecuación (1) (Nernst), que puede simplificarse con las Ecuaciones (2) y (3) [8], [9].
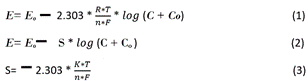
Con E = potencial (mV) entre el ion selectivo y el electrodo de referencia, Eo = potencial (mV) a una concentración estándar (1M), S = pendiente, que depende de la constante universal de los gases (8.314 J mol-1 k-1), la constante de Faraday (96485 C mol-1), la carga eléctrica del ión (1 para nitratos) y la temperatura [8], [9], C = Concentración del ion a ser medido y Co = límite de cuantificación del método. Para 25°C el parámetro S toma un valor de – 0.059
En comparación a la técnica de Reducción cadmiocobre, el Ion selectivo permite ampliar el rango lineal y disminuir tanto los costos (en tiempo y reactivos) como el impacto ambiental (reactivos y efluentes) asociado a la cuantificación de nitratos en agua.
Dado que la meta de un análisis químico de aguas es generar resultados confiables, la validación de ensayos corresponde a uno de los aspectos más importantes para conseguir este propósito; además se constituye un factor clave para la prestación de servicios analíticos [10]. En la presente contribución se describe la evaluación para la cuantificación de nitratos usando la técnica de Ion selectivo. Las pruebas incluyen determinación de selectividad, sensibilidad, límite de cuantificación, exactitud, precisión, significancia, robustez, incertidumbre del método y aplicabilidad para la determinación de nitratos en estándares y muestras reales de aguas naturales, residuales y tratadas.
2. MATERIALES Y METODO
Se utilizó un medidor portátil HQ30d (marca HACH), siguiendo el método 4500-NO3- D del Standard Methods for the Examination of Water and Wastewater, Edición 22, y bajo recomendaciones de la norma NTC ISO IEC 17025 [11], ejecutando diferentes tareas experimentales que incluyeron:
2.1 Ajustador de potencia iónica de nitrato
Se utilizó 0.40 gramos de NaH2PO4°H2O por cada 25 mL de muestra para ajustar el pH de la muestra a un rango entre 3 – 5, garantizando la eliminación de posibles interferencias por carbonatos y ácidos orgánicos [9]
2.2 Rango lineal de la curva de calibración
Para determinar el intervalo de concentración donde se garantiza un comportamiento lineal en la respuesta instrumental [12], se construyó una curva de calibración con 5 estándares de diferente concentración (0.113; 0.226; 0.565; 1.130 y 2.259 mg NO3 - -N/L). Cada medición se hizo por cuadruplicado y se evaluaron como parámetros estadísticos t coeficiente de correlación (tr), intercepto (tb) y pendiente (tm), cada uno de ellos con base en el modelo del estadístico de Student [13], [14]. El intervalo seleccionado [0.113 – 2.259] corresponde a valores donde se encuentra gran cantidad de muestras analizadas en laboratorios de calidad del agua [13].
2.3 Límite de cuantificación del método
En este trabajo se verificó si el límite inferior de la curva de calibración puede considerarse como el límite de cuantificación del método, para ello se prepararon 10 soluciones estándar de la concentración del límite inferior de la curva de calibración (asumido cono el límite de cuantificación), se midió experimentalmente la concentración de nitratos en cada solución usando la técnica de Ion selectivo y se calculó el promedio, la desviación estándar [14], el coeficiente de variación [14] y el porcentaje de error [14]. De acuerdo a recomendaciones de [13], si el coeficiente de variación y el porcentaje de error de los datos obtenidos son menores al 15%, se acepta el resultado como el valor estimado para el límite de cuantificación. De lo contrario se hace necesario determinar otro valor como límite de cuantificación aumentando la concentración del estándar para esta prueba y repitiendo el procedimiento [13]. Vale la pena aclarar que límite de detección del método podría ser inferior a 0.113, pero por aspectos prácticos no se determinan valores inferiores.
2.4 Intervalo de confianza, precisión y exactitud del método
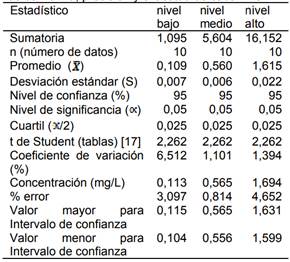
De acuerdo al rango lineal de la curva de calibración, para determinar el intervalo de confianza, la precisión y la exactitud del método se definieron tres niveles de concentración de nitratos: alto (1.694 mg NO3- -N/L), medio (0.565 mg NO3- -N/L) y bajo (0.113 mg NO3 -N/L).
El intervalo de confianza, Ecuación (4) [15] [16], corresponde a un rango de valores, cuya distribución es normal y en el cual se encuentra, con “alta probabilidad” (generalmente 95 %), el valor real de una determinada variable.
![]() (4)
(4)
![]() Con
Con ![]() = intervalo de confianza, = promedio,
= intervalo de confianza, = promedio, ![]() = de
= de ![]() Student para el 95% de confianza con n-1 grados
de libertad (
Student para el 95% de confianza con n-1 grados
de libertad (![]() =0.05), S = desviación estándar, n = número de
réplicas analizadas.
=0.05), S = desviación estándar, n = número de
réplicas analizadas.
Por otro lado, la precisión se refiere a la dispersión del conjunto de valores obtenidos de mediciones repetidas, mientras que la exactitud evalúa el grado de aproximación entre el valor promedio obtenido experimentalmente y un valor de referencia aceptado. Para determinar si el método es exacto y preciso se calculó el valor de parámetros estadísticos como coeficiente de variación (precisión) y porcentaje de error (veracidad) con los valores de concentración obtenidos en las diez réplicas de cada nivel de concentración. Cuando el valor de dichos parámetros resulta inferior al 15%, la técnica utilizada cumple con los criterios de precisión y exactitud [14].
2.5 Prueba de significancia
El objetivo de una prueba de significancia es comparar el método que se desea implementar con el método actualmente utilizado, para así garantizar que el nuevo método proporciona mediciones adecuadas y confiables. La prueba de significancia se realizó analizando mediante los métodos de Ion selectivo y Reducción cadmio-cobre la concentración de nitratos en 4 muestras diferentes: agua para consumo humano (tratada), agua natural, agua residual y estándar certificado. Cada muestra se analizó con 10 réplicas. Los datos obtenidos para cada muestra se depuraron usando el estadístico de Grubbs (T) [13] y luego se aplicó el estadístico F“ Test” o “F de Fisher” y el estadístico “ Test” o “t de Student” para comprobar la veracidad de la hipótesis experimental o hipótesis alternativa H1 (sí hay diferencia entre los dos métodos) con respecto a la hipótesis nula H0 (no hay diferencia entre los dos métodos) [14].
Para el F“ Test” (F de Fisher), se calculó la varianza en las concentraciones obtenidas por ambos métodos, Ecuación (5):
![]() (5)
(5)
Con
S2= Varianza, ![]() = Promedio, X= Valor de la concentración
leído en el equipo, n= Numero de lecturas.
= Promedio, X= Valor de la concentración
leído en el equipo, n= Numero de lecturas.
Posteriormente
se calculó la F de Fisher usando la Ecuación (6) para comprobar la veracidad de
la hipótesis experimental H1, con respecto a la hipótesis nula H0
utilizando la prueba de dos-colas, donde el valor calculado para la F de Fisher
(Ecuación (6)) debe estar en la región de aceptación, entre el valor de ( ![]() /2) de la izquierda (obtenido con la función de
Microsoft Excel “INV.F”) y el valor (
/2) de la izquierda (obtenido con la función de
Microsoft Excel “INV.F”) y el valor ( ![]() /2) de la derecha (obtenido de tablas de Fisher
con un 95 % de probabilidad [17]). Para los casos en los cuales la prueba F de
Fisher permitió concluir que las varianzas no eran significativamente
diferentes, se realizó adicionalmente el test
/2) de la derecha (obtenido de tablas de Fisher
con un 95 % de probabilidad [17]). Para los casos en los cuales la prueba F de
Fisher permitió concluir que las varianzas no eran significativamente
diferentes, se realizó adicionalmente el test ![]() -student (“
-student (“![]() Test”).
Test”).
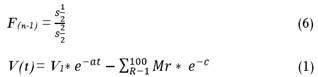
![]() Donde
Donde ![]() = F de Fisher,
= F de Fisher, ![]() = varianza
de las réplicas (Reducción cadmio-cobre), = varianza de las réplicas (Ion
selectivo).
= varianza
de las réplicas (Reducción cadmio-cobre), = varianza de las réplicas (Ion
selectivo).
El
Test de ![]() -student permitió comparar las medias de dos
grupos de datos y determinar si sus diferencias eran estadísticamente
significativas [13] [14]. Una vez concluido que las varianzas no eran significativamente
diferentes a través del “F Test”, se realizó la estimación de la desviación
estándar conjunta, Ecuación (7).
-student permitió comparar las medias de dos
grupos de datos y determinar si sus diferencias eran estadísticamente
significativas [13] [14]. Una vez concluido que las varianzas no eran significativamente
diferentes a través del “F Test”, se realizó la estimación de la desviación
estándar conjunta, Ecuación (7).
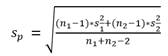 (7)
(7)
Con
![]() = Desviación
estándar conjunta,
= Desviación
estándar conjunta, ![]() = varianza de las réplicas (Reducción
cadmio-cobre),
= varianza de las réplicas (Reducción
cadmio-cobre), ![]() = varianza de las réplicas (Ion selectivo),
= varianza de las réplicas (Ion selectivo), ![]() = número de
réplicas (Reducción cadmio-cobre),
= número de
réplicas (Reducción cadmio-cobre), ![]() = número de réplicas (Ion selectivo).
= número de réplicas (Ion selectivo).
Posteriormente
se calculó el ![]() usando la Ecuación (8) y por tablas [17] con
((n1 + n2) -2) grados de libertad y con un intervalo de
confianza de 95%. Cuando el valor de
usando la Ecuación (8) y por tablas [17] con
((n1 + n2) -2) grados de libertad y con un intervalo de
confianza de 95%. Cuando el valor de ![]() calculado (Ecuación (8)) resultó menor que
calculado (Ecuación (8)) resultó menor que ![]() el leído de tablas, se aceptó la hipótesis nula
H0, (no hay diferencia entre los dos métodos) concluyéndose que los
métodos son estadísticamente similares.
el leído de tablas, se aceptó la hipótesis nula
H0, (no hay diferencia entre los dos métodos) concluyéndose que los
métodos son estadísticamente similares.
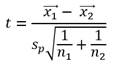 (8)
(8)
Con
![]() =
= ![]() calculado,
calculado, ![]() 1= promedio de las
réplicas (Reducción cadmio-cobre),
1= promedio de las
réplicas (Reducción cadmio-cobre), ![]() 2 = promedio de las réplicas
(Ion selectivo).
2 = promedio de las réplicas
(Ion selectivo).
2.6 Incertidumbre del método
Las mediciones analíticas tienen una incertidumbre asociada que debe estimarse para darle al resultado de la medición un carácter de alta confiabilidad [18]. Para este estudio se estimó la incertidumbre relativa expandida [19] con base en la medición o determinación de la incertidumbre estándar de instrumentos y equipos [20], la incertidumbre de la curva de calibración [21] y la incertidumbre asociada al pesaje del ajustador de potencia iónica [21] [22].
3. RESULTADOS
3.1 Rango lineal de la curva de calibración
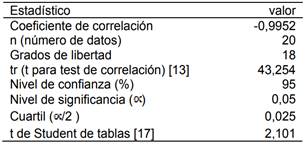
El resultado de las lecturas (cuadruplicado) para cada uno de los estándares preparados se muestra en la Tabla 1 y los estadísticos para la prueba del coeficiente de correlación (tr), pendiente (tb) e intercepto (ta) en las Tablas 2, 3 y 4, respectivamente.
Tabla 1. Datos para la construcción de la curva de
calibración.
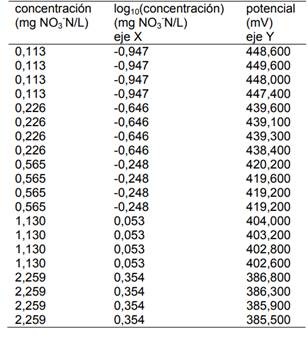
Tabla 2. Estadísticos para la prueba del coeficiente de correlación.
3.2 Límite de cuantificación del método
Las lecturas de la concentración de nitratos en la solución estándar para el límite inferior de la curva de calibración se muestran en la Tabla 5 y en la Tabla 6 los estadísticos para evaluar si la concentración de 0,113 mg/L cumple con los criterios del límite de cuantificación.
Tabla 3. Estadísticos para la prueba de la pendiente

Tabla 4. Estadísticos para la prueba del intercepto

Tabla 5. Datos obtenidos por el método de Ion selectivo para el límite de cuantificación.
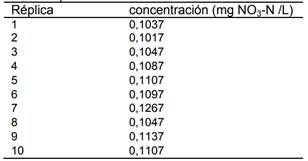
Tabla 6. Estadísticos para evaluar el límite de cuantificación

3.3 Intervalo de confianza, precisión y exactitud del método
Los datos (lecturas) para los estándares preparados en cada nivel de concentración se presentan en la Tabla 7. Por otro lado los estadísticos para el intervalo de confianza, precisión y exactitud se muestran en la Tabla 8.
Tabla 7. Concentración determinada por el método de Ion selectivo para cada uno de los estándares en sus diferentes niveles de concentración
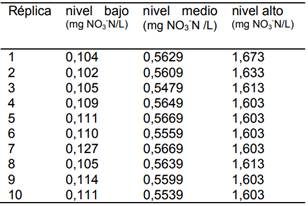
Tabla 8. Estadísticos para determinar el intervalo de confianza, precisión y exactitud de cada nivel
3.4 Prueba de significancia
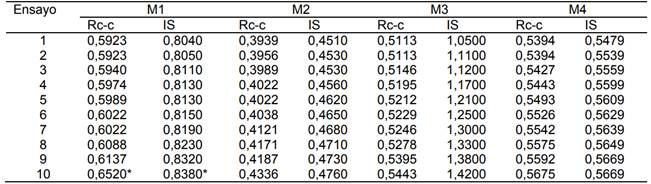
El resumen de los estadísticos de las pruebas F de Fischer y t de Student para la comparación de la cuantificación de nitratos usando el método de Reducción cadmio-cobre y el de Ion selectivo en agua de consumo humano (potabilizada), agua natural, agua residual y estándar certificado se presentan en la Tabla 9. Los datos respectivos (cuantificación de nitratos por cada métodos) se muestran en la Tabla 10.
Tabla 9. Resumen de estadísticos F de Fisher y t de Student para los datos de la Tabla 9
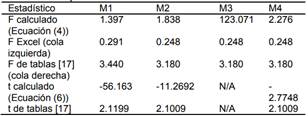
M1 = agua para consumo humano, M2 = agua natural, M3 = agua residual, M4 = estándares. N/A = no aplica
3.5 Incertidumbre del método
La incertidumbre estándar y relativa de instrumentos y equipos se obtuvo a través de los fabricantes y/o certificados para los instrumentos de medición. Para las curvas de calibración y pesaje de ajustador de potencia se realizaron mediciones experimentales y su correspondiente análisis estadístico. Los resultados de incertidumbre combinada e incertidumbre expandida [19] (Tabla 11) se estimaron usando datos de la incertidumbre en la resolución multiparámetro, incertidumbre del pH-metro, resolución del pH-metro, incertidumbre de calibración de la balanza, resolución de la balanza, repetitividad de la balanza, incertidumbre en pipetas volumétricas, balones volumétricos y estándares, reproducibilidad de las mediciones, incertidumbre en la curva de calibración y la incertidumbre asociada al pesaje del ajustador de potencia iónica [18], [19], [20], [21], [22].
Tabla 10. Cuantificación de nitratos usando el método de Reducción cadmio-cobre y el de Ion selectivo en diferentes muestras