1. INTRODUCCIÓN
Según la OMS, Organización Mundial de la Salud, (2015) el agua dulce es un recurso limitado y su calidad está bajo presión constante debido al aumento de contaminación [1]. Sus diferentes usos: abastecimiento de agua potable, producción de alimentos, piscicultura, zoocría, riego y el uso recreativo exigen un monitoreo constante de la calidad química y microbiológica de este recurso [1]. Se considera como agua contaminada aquella cuya composición se ha visto alterada de tal forma que no cumple con las condiciones óptimas para sus diferentes usos. Entre los contaminantes, es común encontrar agentes patógenos causales de enfermedades entéricas y no entéricas que alteran la calidad microbiológica del agua y causan, cada año, la muerte de millones de personas a nivel mundial [2]. Para el 2013, la OMS reportó que en los países en vía de desarrollo, un alto porcentaje de las enfermedades son transmitidas por el agua, siendo las diarréicas la segunda causa principal de muerte infantil. Adicionalmente, existen registros que determinan que por año mueren alrededor de 760.000 niños menores de cinco años debido al consumo de aguas contaminadas y a un saneamiento deficiente de las mismas [3]. Por otro lado, actividades como la pesca y la recreación exigen una calidad microbiológica del agua que garantice la salud de las personas y los ecosistemas acuáticos.
Los métodos para la detección de microorganismos patógenos de origen intestinal en el agua, en general son de alto costo e implican largos tiempos para su determinación, en comparación con los Coliformes totales y Escherichia coli. Estos microorganimos se constituyen en excelentes indicadores de contaminación, al hacer la correspondencia con la presencia de otros patógenos de vías intestinales. Determinar la presencia de estos indicadores en el agua permitirá sugerir la calidad microbiológica de la matriz agua natural.
Con el propósito de contar con una herramienta confiable y precisa, que permita identificar la calidad microbiológica del agua en fuentes naturales, en relación con la presencia de Coliformes totales y E. coli, el grupo de Investigación en Gestión y Modelación Ambiental GAIA, efectuó la estandarización y verificación de la metodología Colilert, en una matriz de agua natural. Los resultados obtenidos, serán el instrumento con el cual los usuarios podrán establecer puntos
críticos de vigilancia y control, además del origen de la contaminación que podría afectar las fuentes de agua.
La verificación es la comprobación de la aptitud de cada laboratorio, bajo sus condiciones particulares de operación, para implementar metodologías de ensayo que ya han sido validadas. La metodología Colilert o Enzima-Sustrato definido Colilert, se fundamenta en la actividad enzimática de los Coliformes totales y E. coli. Esta se constituye en una prueba eficaz y rápida en la detección de los indicadores sanitarios de calidad del agua anteriormente mencionados, puesto que la expresión enzimática del grupo Coliformes reacciona muy selectivamente con el sustrato suministrado para dicha prueba, evitando así falsos resultados que podrían involucrar a otras bacterias fermentadoras de lactosa [4]. La forma de cuantificar las bacterias se realiza por el método del Número Más Probable (NMP), técnica que se basa en las leyes de probabilidades y se utiliza para obtener una estimación del número de bacterias en una muestra [5].
Adicionalmente, la metodología Colilert permite procesar simultáneamente un volumen importante de muestras, por el reducido espacio que se requiere y por la minimización de materiales y reactivos empleados en comparación con otras metodologías. Este método es muy sensible y se puede aplicar en un rango de 1 a 1800 NMP/100mL para detectar y cuantificar la concentración de Coliformes totales y E. coli. [4] El objetivo principal de éste trabajo fue verificar la metodología Colilert para la determinación y cuantificación de Coliformes totales y E. coli en una matriz de agua natural, según los lineamientos establecidos en la Norma Internacional ISO/9308-2:2012 [6, 7, 8, 9].
2. METODOLOGÍA
2.1 Lugar de muestreo: Lago del Jardín Botánico Joaquín Antonio Uribe de Medellín, ubicado en el departamento de Antioquia, Colombia (Ver Figura 1).
2.2 Procedimiento en el laboratorio: Los análisis se realizaron en el grupo de Investigación en Gestión y Modelación Ambiental GAIA. En cámara de flujo laminar se midieron 100 mL de la muestra de agua natural en una probeta estéril y se llevaron a un frasco estéril de 250 mL. Se añadió el contenido de un blíster Colilert. Se tapó y se agitó diez veces el recipiente hasta disolver. Se vertió el contenido del recipiente en una bolsa QuantiTray/2000, se eliminaron las burbujas y se selló en un IDEXX Quanti-Tray Sealer. Las bolsas se incubaron a 35 ± 1ºC durante 18 a 24 horas. Las lecturas se realizaron de acuerdo a lo establecido en la Norma Internacional ISO/9308-2:2012. Se realizaron lecturas preliminares entre las 18 y 22 horas de incubación y una lectura final entre las 24 y 28 horas.
El resultado se reportó de acuerdo a la Tabla IDEXX Quanti-Tray/2000:
-Sin coloración amarilla ni fluorescencia → Resultado negativo para Coliformes totales y E. coli.
- Amarillo igual o mayor al comparador IDEXX, Comparador Quanti-Tray/2000 N º WQT2KC → Resultado positivo para Coliformes totales. - Amarillo igual o mayor al comparador IDEXX y con fluorescencia azul Resultado positivo para E. coli.
Durante todo el ensayo se garantizó la esterilidad siguiendo los lineamientos establecidos en la Norma Técnica Colombiana NTC 4543 de 1998[10].
Fig 1. Lago del Jardín Botánico Joaquín Antonio
Uribe, Medellín, Antioquia, Colombia.
2.3 Toma de muestra y siembra inicial (día 1)
Se colectaron 20 litros de agua natural en un recipiente plástico (botellón), se transportaron y almacenaron durante una hora bajo condiciones de refrigeración, entre 4 a 8ºC, siguiendo lo establecido en la ISO 19458 [11].
En el laboratorio de microbiología del Grupo de Investigación en Gestión y Modelación AmbientalGAIA, se realizaron 6 diluciones en agua destilada
estéril a partir de la muestra de agua natural y se sembró con un blíster Colilert con el fin de conocer la concentración inicial de microorganismos en la muestra.
2.4 Selección de la dilución de trabajo y límites
de detección (día 2)
Se efectuaron las lecturas de los resultados para determinar la presencia y la concentración de los indicadores Coliformes totales y E. coli.
Se tomaron las cepas ATCC Escherichia coli 25922, Citrobacter freundii 8090 como control positivo y Pseudomonas aeruginosa 10145 como control negativo. Se activaron 24 horas antes del ensayo en 20 mL de caldo nutritivo, a una temperatura de 35ºC ± 1ºC. Posteriormente, para los dos primeros indicadores se hicieron 9 diluciones seriadas en frascos con 90 mL de agua destilada estéril y se tomaron 4 diluciones según la siguiente clasificación (Tabla 1):
Concentración ALTA: 10-6 NMP/100mL
Concentración MEDIA: 10-7 NMP/100mL
Concentración BAJA: 10-8 NMP/100mL
Límite de detección: 10-9 NMP/100mL
De cada una de la diluciones 10-6, 10-7, 10-8 y 10-9 se tomó 1 mL y se inoculó en 100 mL de agua destilada estéril y se realizó el Procedimiento Colilert (Ver Fig. 2).
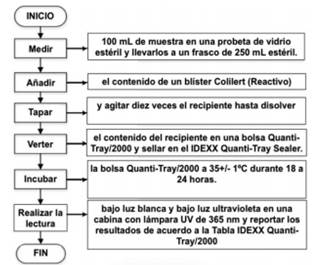
Fig 2. Procedimiento Colilert
El cálculo del límite de detección se realizó a partir de la fórmula 1 [4]:
![]()
En donde, P(+): Probabilidad de detectar la presencia del analito
e: Es la base de logaritmo natural
m: en el número promedio de partículas por porción
analítica.
2.5 Precisión: Repetibilidad y Precisión Intermedia (día 3)
Se seleccionó una dilución de la muestra de agua natural en la cual se obtuvieron recuentos de los indicadores. Luego, dos analistas sembraron esta muestra, siguiendo el procedimiento Colilert, de tal forma que se obtuvieran 15 repeticiones por analista y 30 datos por muestra.
Posterior a lectura de los resultados, se realizó una normalización (Log10) de los datos y se obtuvo la media, la varianza y la desviación estándar. A partir de estos datos se calcularon los límites de confianza de la prueba, la repetibilidad y la precisión intermedia, a través de las fórmulas 2 y 3, respectivamente:

2.6 Exactitud. Porcentaje de Recuperación (día 4 y 5)
Con el fin de observar la recuperación de los indicadores se analizó la muestra de agua natural a través del método Colilert y paralelamente, se analizó la misma muestra con adición de un inóculo de referencia conocido. El porcentaje de recuperación se calculó de acuerdo al valor promedio de la muestra inoculada sobre la suma del promedio de la cepa y el promedio de la muestra. Una baja recuperación comparada con la recuperación del estándar es una razón para reconsiderar la aplicación del método [12].
La fórmula utilizada para hallar el porcentaje de recuperación fue la siguiente:
![]()
Donde,
%R = Porcentaje de recuperación
3. RESULTADOS
3.1 Recuento inicial de la muestra de agua natural: Jardín Botánico Joaquín Antonio Uribe
La muestra fue positiva para Coliformes totales y E. coli con una carga inicial de 52,015 NMP/Coliformes totales y 2,894.67 NMP/E. coli en 100mL. A partir de estos resultados se realizó una dilución a la muestra de agua natural hasta 10-2 para garantizar el recuento de los indicadores durante el ensayo de verificación.
3.2 Selección de la dilución de trabajo de las cepas
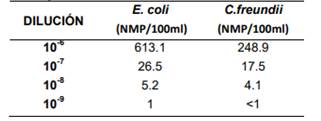
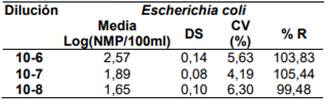
Los resultados de las diluciones Alta, Media, Baja y Límite de detección para Escherichia coli 25922 y Citrobacter freundii 8090, se presentan en la Tabla1:
Tabla 1. Límite de detección para Escherichia coli 25922 y Citrobacter freundii 8090
3.3 Límite de detección
Cuando el límite de detección se define en términos de la probabilidad de registrar un resultado positivo, debe calcularse con la ecuación 1.
A continuación se presentan los resultados para Citrobacter freundii 8090 y Escherichia coli 25922 en las Tablas 2 y 3.
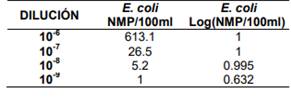
Tabla 2. Límite de detección del método Colilert
para Escherichia coli 25922.
Una de las definiciones del límite de detección es “la concentración a la cual la probabilidad de detectar la presencia del analito es igual al 95%,
p(+)= 0.95” [12]. Por lo tanto el límite de detección del método Colilert para E. coli y C. freundii se presenta en la dilución 10-8 , ya que en 10-9 la probabilidad de detección es menor al 95%.
Tabla 3. Límite de detección del método Colilert para Citrobacter freundii 8090

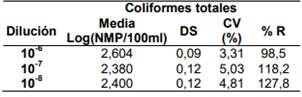
3.4 Repetibilidad
Los resultados de la repetibilidad para el Analista 1 y 2, se presentan en la Tabla 4 y 5.
Tabla 4. Repetibilidad del ensayo realizado por el analista 1.
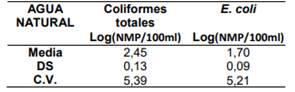
El Analista 1 obtuvo un 94.6% de repetibilidad para la determinación de Coliformes totales y un 94.8% para la determinación de E. coli con el método Colilert en una matriz de agua natural.
Tabla 5. Repetibilidad del ensayo realizado por el analista 2
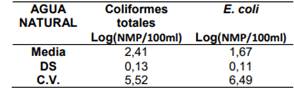
El Analista 2 obtuvo un 94.5% de repetibilidad para la determinación de Coliformes totales y un 93.5% para la determinación de E. coli con el método Colilert en una matriz de agua natural.
3.5 Precisión Intermedia
Los resultados de la precisión intermedia del Analista 1 y 2, se presentan en la Tabla 6.
En el ensayo realizado por los analistas, se obtuvo un 94.58% de confianza para la determinación de Coliformes totales y un 94.08% de confianza para la determinación de E. coli.
Tabla 6. Precisión Intermedia del ensayo realizado por los analistas 1 y 2.
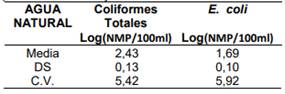
Después de normalizar los datos con la función Log10 y realizar el análisis de varianza de un factor para el recuento (NMP/100mL) de Coliformes totales y E. coli en 15 repeticiones para cada uno de los analistas, se obtuvo un valor de F menor que el F crítico, lo cual significa que se acepta la igualdad de medias, es decir, no existen diferencias significativas entre los Analistas 1 y 2.
3.6 Porcentaje de recuperación
El porcentaje de recuperación para Coliformes totales y Escherichia coli, utilizando la cepa Escherichia coli ATCC 25922, para la concentración alta, media y baja se presentan en las Tablas 7 y 8.
Tabla 7. Resultados estadísticos del porcentaje de recuperación para Coliformes totales en una matriz de agua natural, utilizando E. coli ATCC 25922
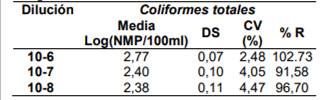
Tabla 8. Resultados estadísticos del porcentaje de recuperación para E. coli en una matriz de agua natural, utilizando Escherichia coli ATCC 25922
El porcentaje de recuperación para Coliformes totales, utilizando la cepa Citrobacter freundii ATCC 8090, para la concentración alta, media y la baja se presentan en la Tabla 9.
Tabla 9. Resultados estadísticos del porcentaje de recuperación para Coliformes totales en una matriz de agua natural, utilizando Citrobacter freundii ATCC 8090.
De acuerdo con los criterios de aceptación consignados en la Norma Internacional ISO/9308- 2:2012, la GTC 84 del 2003 y el Standard methods for the examination of water and wastewater 9223, se expresan a continuación los resultados obtenidos en el proceso de verificación.
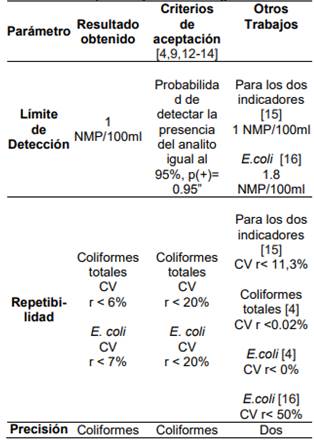
Límite de detección:
El límite de detección del método Colilert para Citrobacter freundii y E. coli se presenta en la dilución 10-8 con 4 NMP/mL para C.freundii y 5
NMP/mL para E. coli.
Repetibilidad:
El criterio de aceptación para Coliformes totales y E. coli es un coeficiente de variación menor al 20%.[4, 9].
En la verificación del grupo GAIA se obtuvo una repetibilidad para Coliformes totales con un CV <6% y para E. coli un CV < 7%, valores ubicados dentro de los criterios de aceptación.
Precisión Intermedia:
El criterio de aceptación de la precisión Intermedia para Coliformes totales y E. coli es un Coeficiente de variación menor a 20% [4, 9].
La verificación realizada en el grupo GAIA reportó un CV < 6% tanto para Coliformes totales como para E. coli, estando dentro del criterio de aceptación.
Exactitud:
Los criterios de aceptación para estas variables especifican que el método debe tener un porcentaje de recuperación entre 80 y 120% para Coliformes totales y E. coli [13 -14].
En esta verificación, se obtuvo un porcentaje de recuperación para Coliformes totales de 98 > %<128 y para E. coli del 99 > %< 106. Se demostró la exactitud del método ya que los porcentajes de recuperación realizados a las muestras de agua natural estuvieron entre 80 y 120% tanto para E. coli como para Citrobacter freundii [13 -14].
4. DISCUSIÓN
Verificar metodologías de análisis microbiológico, se ha convertido en una prioridad para las entidades y grupos de investigación que como el GAIA buscan ofrecer a la sociedad un servicio confiable y oportuno en la determinación de la alidad microbiológica del recurso hídrico. El proceso de verificación permite generar certeza sobre los resultados obtenidos, en cumplimiento de criterios de calidad y seguridad, que estén acordes con la Normatividad vigente en el país y que puedan ser reconocidos internacionalmente.
Al comparar los resultados de éste trabajo con otros que aplican la metodología Colilert (Tabla 10), se observa que se cumple con los criterios de aceptación.
Tabla 10. Comparación de los resultados con los criterios de aceptación y otras investigaciones.

5. CONCLUSIONES
La metodología Sustrato Definido-Colilert (NMP/100mL), es altamente reproducible para la determinación de Coliformes totales y Escherichia coli en una matriz de agua natural.
Durante el proceso se evaluaron los parámetros Límite de detección, Repetibilidad, Precisión intermedia y Exactitud del método, obteniendo resultados satisfactorios con respecto a los criterios de aceptación consignados en la Norma Internacional ISO/9308-2:2012, la GTC 84 del 2003 y el Standard methods for the examination of wáter and wastewater.
La metodología Colilert brinda confiabilidad y oportunidad en los resultados de tal manera que se puedan reconocer puntos críticos de contaminación en los cuerpos de agua y la calidad microbiológica de dicha fuente en relación con los indicadores Coliformes totales y E. coli, permitiendo la implementación de medidas de control en beneficio de la salud pública.
Los resultados obtenidos demostraron que el método es Preciso y Exacto, por tanto, es apropiado para su desarrollo en el laboratorio de microbiología del Grupo GAIA y para la prestación del servicio.
6. AGRADECIMIENTOS
Los autores agradecen a la Universidad de Antioquia, a David González de la empresa Aqualab por su asesoría y acompañamiento y al Departamento Administrativo de Ciencia, Tecnología e Innovación (Colciencias) por el soporte financiero al proyecto: COL13-1-12 ”Validación y acreditación de la metodología Colilert para la determinación de Coliformes totales y Escherichia coli en una matriz de agua natural para el Grupo de Investigación en Gestión y Modelación Ambiental, GAIA” en el marco de la convocatoria 561 del año 2012.
7. Referencias Bibliográficas
[1]. Organización Mundial de la Salud, OMS. Agua. Nota descriptiva Nº391, Centro de Prensa, 2014 Disponible en : http://www.who.int/mediacentre/factsheets/fs391/es/ [Consultada el 1 de Septiembre de 2015]
[2]. Organización Mundial de la Salud, OMS. Guidelines for safe recreational water environments Volume 1: Coastal and fresh waters, Chapter 4 Faecal pollution and water quality, 2003.
[3]. Organización Mundial de la Salud, OMS. Enfermedades diarréicas. Nota descriptiva Nº 330, Centro de Prensa, 2013. Disponible en: http://www.who.int/mediacentre/factsheets/fs330/es/ [Consultado el 5 de Septiembre de 2015]
[4]. IDEXX. Validación del método Colilert®- 18/Quanti-Tray® para el recuento de E. coli y de bacterias coliformes en muestras de agua, One IDEXX Drive, Westbrook, Maine 04092, EE. UU, 2008.
[5]. García, G., Velásquez, L.F., Gómez, G., Pineda, F. y Saldarriaga, Y. Manual de laboratorio de microbiología general. Universidad de Antioquia, Facultad de Ciencias Exactas y Naturales. Instituto de Biología, Medellín, 2004.
[6]. República de Colombia. Usos del agua y residuos líquidos. República de Colombia. Decreto1594 de 1984. Bogotá. 1984.
[7]. Norma técnica Colombiana. Requisitos generales para la competencia de los laboratorios de ensayo y calibración, NTC-ISO/IEC 17025, ICONTEC, Ed 2005.
[8]. República de Colombia. Normas técnicas de calidad del agua potable, Decreto 475 de 1998, Bogotá, 1998.
[9]. International Standards Organization, ISO. Calidad del Agua- Enumeración de Escherichia coli y bacterias Coliformes- Parte 2: Método del número más probable, NORMA ISO/9308-2, 2012.
[10]. Instituto Colombiano de Normas Técnicas y Certificación, ICONTEC. Esterilización de productos para el cuidado de la salud. Requisitos para validación y rutina de control, Esterilización por calor húmedo industrial, Norma técnica Colombiana NTC 4543, Bogotá,D.C,1998.
[11]. International Standards Organization, ISO. Provides guidance on planning water sampling regimes, on sampling procedures for microbiological analysis and on transport, handling and storage of samples until analysis begins, ISO 19458:2006 focuses on sampling for microbiological investigations, ISO 19458, 2006.
[12]. Guidance on Validation of Microbiological Methods. Calidad del agua, Guía para la orientación acerca de la validación de métodos de análisis microbiológicos, Adopción idéntica (IDT) por traducción de la ISO/TR 13843:2000 Water Quality, GTC 84, 2003.
[13]. American Public Health Association. Standard methods for the examination of water and wastewater. 9223, Enzyme Substrate Coliform Test, Vol 2, 22ND Edition, Washington DC, 2012.
[14]. American Public Health Association. Standard methods for the examination of water and wastewater, 9221 C, Estimation of Bacterial Density, Vol 2, 22ND Edition, Washington DC, 2012.
[15]. Roa-Navarro, M.O., Orjuela L.C y SolanoDuque, M.E. Determinación de Coliformes totales y E. Coli de aguas mediante la técnica de sustrato definido, colilert por el método de Numero Más Probable. Instituto de Hidrología, Meteorología y Estudios Ambientales, Ministerio de Ambiente, Vivienda y Desarrollo Territorial, República de Colombia, Subdirección de hidrología, Grupo laboratorio de Calidad Ambiental, Código TP0423, Versión 02, 2007.
[16]. Mathieu, N. Quality Assurance Project Plan, Fecal Coliform Method Comparison Study in Estuarine Waters of Washington State, Washington State Department of Ecology, 2012.
[17]. Bohn, G y Brouillard, E. Alternative Bacteria Source Identification using Colilert®/Quanti-Tray 2000 Test Method in Irrigated Agricultural Watersheds, Washington State Department of Ecology, 2011.