1. INTRODUCCIÓN
El Acceso Venoso Central (AVC) en pediatría es un procedimiento mínimamente invasivo que por medio de un catéter ayuda al seguimiento de la presión venosa central, a proporcionar antibióticos por vía intravenosa, nutrientes, medicamentos y rehidratación entre muchos otros usos, en los casos en que el acceso venoso periférico no es posible por múltiples razones como el estado de shock y colapso de las venas periféricas [1][2]. Su implantación exige gran destreza y conocimiento por parte del especialista tratante con el agravante de representar grandes riesgos para la vida del paciente cuando se practica sin la técnica adecuada [3]. Tradicionalmente, el proceso de aprendizaje de esta técnica es apoyado por la documentación que se encuentra en los libros de texto especializados, videos instructivos, figuras que representan el AVC y prácticas en animales.
Con los avances en la simulación y la realidad virtual, el desarrollo y el uso de la simulación como una herramienta complementaria está ganando impulso, aunque su disponibilidad es todavía limitada debido a los costos y las necesidades de infraestructura [4][5][6]. La disponibilidad de la información y los materiales en su mayoría se centran en adultos, dejando brechas sobre cómo realizar el procedimiento en pacientes pediátricos cuyas características anatómicas difieren de los adultos [7][8].
El principal reto para alcanzar un grado de experticia en el procedimiento del AVC es la dificultad para la práctica in situ, porque depende de la disponibilidad de restos de animales, humanos y simuladores médicos basados en maniquíes de adultos [9]. Actualmente, la mayoría de las habilidades se desarrollan durante la práctica con pacientes una vez que el médico es certificado para hacerlo, sin embargo, las primeras prácticas tienen un mayor riesgo debido a la falta de experiencia [10] [11]. El conocimiento adquirido proporciona el terreno para ejecutar con éxito el procedimiento
Las herramientas actuales no presentan la posibilidad de un acercamiento al procedimiento en pacientes pediátricos y teniendo en cuenta que sus características difieren de las de los adultos, es importante que sean consideradas al momento del aprendizaje. El objetivo de este trabajo es construir un modelo físico de la piel, músculo y vena para entrenamiento de punción subclavia en AVC en pediatría.
2. GENERALIDADES
Se presentan las características de los materiales biológicos y los materiales sintéticos que pueden ser utilizados en el desarrollo del modelo físico para AVC en pediatría.
2.1. Materiales biológicos: piel, músculo y vena
Piel: Es el órgano más amplio (de 1,5 a 2m2 ) y más pesado (de 3 a 4kg) del cuerpo humano, el cual posee una estructura de capas múltiples, lo que hace que su comportamiento de deformación sea complejo tanto en adultos como en pacientes pediátricos [12]. Tiene tres capas superpuestas entre sí que son: epidermis con un espesor de 0,1mm aproximadamente, dermis con un espesor de 1,1mm aproximadamente e hipodermis con un espesor de 1,2mm aproximadamente [13]. La piel es un material heterogéneo compuesto por fibras de colágeno y elastina en una matriz de proteoglicanos. El módulo de Young de la piel varía entre 4,6 MPa y 20 MPa para ensayos de tracción [14], entre 0,42 MPa y 0,85 MPa para ensayos de torsión [15], entre 0,05 MPa y 0,1 5MPa para pruebas de aspiración [16] y entre 1,1 KPa y 8 KPa para pruebas de indentación [17]. En los pacientes pediátricos las estructuras de la piel son más finas y delgadas que en un paciente adulto haciendo que la piel sea más sensible y propensa al daño, la elasticidad es mayor que en un adulto debido a la baja exposición a factores ambientales que ha tenido por su corta edad y desarrollo [18].
Músculo esquelético: Supone entre el 40 al 45% del peso total del cuerpo. Los tendones y los tejidos conectivos dentro y alrededor del vientre muscular son estructuras viscoelásticas. El comportamiento mecánico del músculo se puede describir mediante un modelo básico que involucra los elementos elásticos en serie, paralelo y el elemento contráctil representado por la actina y miosina; y el endomisio, epimisio, perimisio y sarcolema representan un segundo componente elástico localizado en paralelo con el componente contráctil [19]. En los pacientes pediátricos estas estructuras aunque bien formadas carecen del desarrollo suficiente para realizar movimientos completos y precisos que luego desarrollarán con la evolución y al experiencia. Algunas fibras musculares se desarrollan con la edad lo que hace que la estructura muscular sea más débil y elástica [7].
Vena: Es un vaso sanguíneo de paredes finas y preparadas para soportar baja presión a través de los cuales la sangre retorna al corazón. Se originan mediante pequeños ramos en las redes capilares y siguen dirección contraria a la de las arterias. El diámetro de las venas varía entre 0,1 mm y más de 1 mm [20] [21]. En los pacientes pediátricos las venas son más finas y elásticas, al igual que las arterias. La circulación en recién nacidos cambia al empezar la ventilación pulmonar, esto hace que en el desarrollo del sistema circulatorio las venas también evolucionen [7].
2.2. Materiales usados
Se presenta una selección de materiales comúnmente usados para la elaboración de estructuras similares a los tejidos humanos, evaluados para realizar el modelo físico aquí presentado:
Alginato: Es un material ampliamente usado en odontología para obtener impresiones del dentales [22] [23].
Elastómero de poliuretano: Es un material ampliamente usado por su elasticidad y resistencia a la grasa, el aceite y la abrasión y comúnmente es usado para copiado en moldes [24] [25].
Silicona de platino: Es utilizada en sistemas animatrónicos y en efectos especiales para cine y televisión. Se puede moldear con facilidad, el tiempo de secado se encuentra entre los 20 a 30 minutos a 21°C [26] [27].
Manguera de látex: Es un material ampliamente usado por su elasticidad. Se deforma muy fácilmente con la presión [28]. Manguera de PVC: Es un material resistente, usado en la industria médica posee una elasticidad media [29].
Manguera de silicona grado médico: Es un material de grado médico, libre de látex, que posee alta elasticidad [30].
3. METODOLOGÍA
Se aplicó metodología cuasi experimental [31], que incluye para la construcción del modelo físico la revisión de las características de la piel, músculo y vena, y de materiales sintéticos, a continuación se desarrolló del modelo físico, se realizaron pruebas de punción, corte y tracción sobre los materiales sintéticos y finalmente se realizaron pruebas de percepción del modelo con estudiantes de medicina.
3.1. Materiales sintéticos
Se buscaron materiales con propiedades mecánicas similares. Con el fin de caracterizar los materiales sintéticos. Estos se sometieron a pruebas físicas de punción y de corte y rasgadura.
Prueba de punción: Para esta prueba se usó una jeringa comercial de 5 a 10 ml con aguja, usada en los accesos venosos centrales en neonatología y pediatría. Se insertó la aguja, de manera repetitiva dejando intervalos de 30 segundos en cada inserción por un periodo de 20 minutos, en un ángulo de 45° con respecto a la horizontal simulando la manera de realizar la punción para encontrar la vena en el procedimiento real [32]. Se deja este intervalo de tiempo para que el material se reestablezca después de la punción.
Prueba de corte y rasgadura: Para esta prueba se utilizó un bisturí de disección el cual cortó cada uno de los materiales y luego se realizó una tensión en direcciones opuestas para observar el comportamiento de los materiales ante el posible rasgado.
3.2. Modelo físico de piel, músculo y vena
Se definieron características que servirán para la construcción del modelo de capas y para su posterior validación. Para definir el comportamiento de la piel se empleó el modelo de Ogden [33] el cual describe un material hiperelástico isótropo cuya función de densidadde energía es mostrado en la ecuación 1.
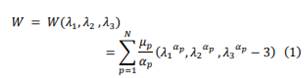
Siendo N un número arbitrario y los parámetros indeterminados representan el módulo cortante
y son constantes adimensionales. En el trabajo realizado por Mahmud se obtuvo que los parámetros µ y α que describen mejor el comportamiento de la piel son µ = 110 Pa y α = 26 [34], se asume que el módulo de Young de la piel oscila entre 4,6 MPa y 20 MPa para ensayos de tracción [14]. Para definir el comportamiento del músculo se optó por el modelo de Mooney-Rivlin que describe un material hiperelástico modelable [35]. Para la vena, en [36] se plantean tres modelos para tejidos venosos. Al comparar sus resultados se observaron valores aproximados al módulo de Young que se define como 82,77 KPa. Debido a que el uso que se le dará a los materiales es un simulador pediátrico se tomarán los valores medios del módulo de elasticidad referenciados en la literatura para realizar la comparación.
El modelo físico se escaló 10:1. Es decir, se manejó un corte de 1 mm x 1 mm equivalente en el modelo a 10 cm x 10 cm. En esta escala la capa de piel tiene un espesor de 1,2 cm aproximadamente, el tejido adiposo un espesor de 1,2 cm, el músculo de 1,5 cm y el diámetro de la vena de 1 cm.
Para realizar el modelo de capas fueron seleccionadas la silicona de platino y silicona de grado médico por las características mencionadas idóneas para su utilización en un simulador que será continuamente perforado. Para cada una de las capas a simular se utilizan diferentes grosores y pigmentos. Para la capa que simulará la piel se realizó una mezcla de silicona de platino pigmentada con color de piel oliva, como se muestra en la Fig. 1, el tejido adiposo se pigmentó con color de grasa y el músculo color rojo sangre.

Fig. 1. Preparación del material para elaborar el
modelo físico de la piel.
Entre cada capa el curado del material se establece hasta obtener una consistencia pegajosa, momento en el que la capa siguiente se adhiere a la anterior por acción de las moléculas del material, evitando el desprendimiento de las mismas. La manguera de silicona que representa la vena se insertó en la capa muscular antes de su secado, luego se dejan curar completamente las capas, y finalmente se pigmenta con pinturas para silicona para hacer que el modelo sea visualmente similar a la realidad.
3.3. Verificación del modelo físico
Para realizar la verificación del modelo construido se realizan las siguientes pruebas:
Prueba de material: Se evaluó la silicona de platino utilizando la técnica de tracción. Para ello se utilizó una máquina de ensayo universal WP300 de la empresa GUNT Hamburg modificada con una celda de carga de 50 kN y velocidad máxima de 10rpm con un recorrido de 30 mm de deformación [37]. En la prueba se toma una probeta del material con un área transversal de 17 mm x 6 mm o de 1,02e -4 m 2 y se realiza una prueba de tensión obteniendo una gráfica de esfuerzo versus deformación, que permite observar el comportamiento elástico y plástico del material sometido. Para evaluar la manguera de silicona de grado médico se usó una probeta cilíndrica con diámetro interno de 6 mm y diámetro externo de 11 mm sobre la cual se realizó un ensayo de tracción.
Percepción del modelo físico de piel: Para evaluar la percepción del modelo físico de piel se diseñó y aplicaron una encuesta a estudiantes de cuarto año de medicina. Se les invitó a ver y a palpar libremente con sus manos una muestra de 10cm x 10cm del modelo físico de piel propuesto por 2 minutos. Se hizo claridad que este modelo debía compararse con la sensación visual y táctil de la zona subclavia de un paciente pediátrico. Posteriormente se les presentó un cuestionario donde evaluaron de 0 a 5 (siendo 0 menos parecido y 5 más parecido) las propiedades de pigmentación, aspecto visual, sensación táctil a la palpación y semejanza a la zona subclavia. Se aplicó a estudiantes de la facultad de medicina de la Universidad Militar Nueva Granada, de cuarto año, que comienzan sus prácticas con pacientes. La población es de 30 estudiantes. Para hallar la muestra se aplicó la Ecuación 2.
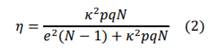
N es el tamaño de la población, k es una constante que depende del nivel de confianza asignado, que indica la probabilidad de que los resultados de la investigación sean correctos, en este del 95,5% es 2, e es el error muestral deseado, de 4,5% para el porcentaje de confianza elegido, p es la proporción de individuos que poseen en la población la característica de estudio, se asume como p=q=0,5, q es la proporción de individuos que no poseen esa característica, 1-p y n es el tamaño de la muestra, 28 estudiantes.
4. RESULTADOS Y DISCUSIÓN
Se presentan a continuación los resultados obtenidos luego de realizar los pasos descritos en la metodología.
4.1. Materiales sintéticos:
El procedimiento de AVC presenta oportunidades para salvar vidas, de allí la importancia de elegir adecuadamente los materiales para un simulador físico que permitan una interacción cercana a la realidad en el procedimiento de AVC en pediatría, Para simular la piel y el músculo se evaluaron los siguientes materiales:
Alginato: Aunque es un material elástico, al ser perforado por una aguja sus moléculas no se reorganizan para cerrar el agujero. Luego de su preparación y curado, el alginato comienza a deshidratarse liberando agua y haciendo que el material sólo pueda ser usado una vez, adicionalmente al ser cortado se rasga fácilmente.
Elastómero de poliuretano: Al ser expuesto a cortes, rasgaduras o punzado no retorna su forma anterior, haciendo que las fibras del material se rompan fácilmente ante la tensión. Lo que lo hace un material no adecuado para el uso con implementos como agujas.
Silicona de platino: Al realizar la prueba de perforación el material vuelve a su estado inicial salvo por las marcas que son casi imperceptibles. Para la prueba de corte se evidencia que requiere una fuerza considerable para que se rasgue.
Para la simulación de la vena se evaluaron los siguientes materiales:
Manguera de látex: Si este material se corta o se perfora en alguna parte de la superficie, se rasga fácilmente y permite el paso de fluidos, lo cual no es deseable para un simulador que se perforará con una aguja continuamente. Se inhibe con la silicona de platino lo que no permite que se puedan poner los materiales en contacto para el curado de la mezcla de silicona.
Manguera de PVC: Aunque permite ser perforado sin rasgarse, no se sella y permite el paso del fluido una vez se hace la perforación.
Manguera de silicona: No se rasga o rompe al ser perforada la perforación se cierra y no permite el paso de fluidos fuera del conducto. Es compatible con la silicona de platino lo que permite que se pueda trabajar con los dos materiales propuestos.
4.2. Desarrollo del modelo físico de piel, músculo y vena
Se obtuvo un modelo físico con las capas de piel, tejido adiposo, vena y músculo a escala 10:1 utilizando silicona de platino y manguera de silicona grado médico, como se muestra en la
Fig. 2.

Fig. 2. Modelo físico de piel, músculo y vena terminado.
El diseño de sistemas para el desarrollo de habilidades orientadas a los recién nacidos e infantes [38] [32], es cada vez necesario. El modelo físico desarrollado permitiría interactuar en forma repetitiva con las estructuras anatómicas de interés y visualizarlas desde cualquier perspectiva, proceso difícil de realizar con los pacientes. Adicionalmente incrementaría la experiencia e interacción de aprendizaje del usuario (estudiante, profesor, especialista) con el modelo, al representar de manera simulada el procedimiento, en comparación con los métodos tradicionales de prácticas en restos humanos o animales.
4.3. Verificación del modelo físico
Se realizaron pruebas en los materiales y evaluación de la percepción visual y táctil.
Prueba de materiales: En las pruebas de los materiales usados para el prototipo se evaluó el esfuerzo versus deformación. Para la silicona de platino se obtuvo que su módulo de elasticidad en la prueba de tracción corresponda en promedio a 10 MPa como se muestra en la Fig. 3
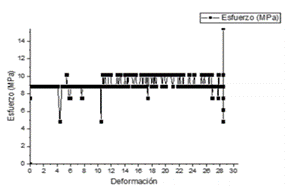
Fig. 3. Esfuerzo versus deformación de la silicona de platino adquirida en el ensayo de tracción.
Para conocer el comportamiento del material se eliminó el ruido de adquisición de la máquina de ensayos por medio de una regresión polinomial presentada en la Ecuación 3, lo que permitió obtener la gráfica mostrada en la Fig. 4.
![]()
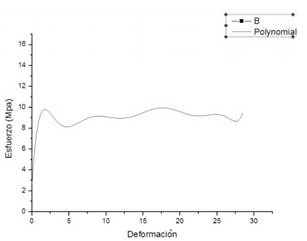
Fig. 4. Esfuerzo versus deformación de la silicona de platino obtenido con regresión polinomial.
En el caso de la manguera de silicona de grado médico se realizó el mismo procedimiento que con la silicona de platino y se obtuvo la gráfica de esfuerzo versus deformación con un módulo de elasticidad de 50 KPa como se muestra en la Fig. 5 y se realizó igualmente una regresión polinomial como se muestra en la Fig. 6. Las mediciones mostraron que el modelo implementado tiene un comportamiento similar al reportado en la literatura para pruebas de tracción [14], lo cual da validez al modelo en evaluación.
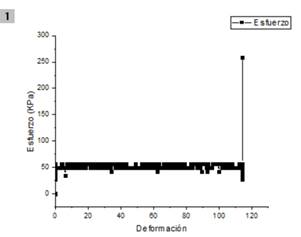
Fig. 5. Esfuerzo versus deformación de la manguera de silicona de grado médico adquirida en el ensayo de tracción.
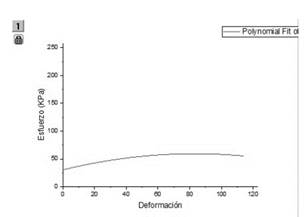
Fig. 6. Esfuerzo versus deformación de la manguera de silicona de grado médico obtenido con regresión polinomial.
De acuerdo con lo obtenido en las pruebas de tracción del material se observa que aunque hay una diferencia entre los módulos de elasticidad encontrados en la literatura para la piel y las venas y los obtenidos en los materiales sintéticos empleados en este modelo, estos tienen valores cercanos, lo que muestra una similitud con lo reportado en la literatura que permite simular la piel. No se encontraron estudios de las propiedades mecánicas de la piel de un neonato, por lo que se considera un módulo de elasticidad promedio encontrado en los materiales para que se asemejan mejor a los tejidos de un paciente pediátrico.
Percepción del modelo físico de piel: En la evaluación sobre la percepción del modelo físico de piel en un grupo de 28 estudiantes de cuarto año de medicina de la Universidad Militar Nueva, se encontró que el 46% evaluó con cuatro y 32% con tres el pigmento utilizado para el modelo físico de piel como adecuado para representar un color de piel humana. El 46% evaluó con cuatro y 36% con cinco la aproximación visual del modelo físico con la piel. El 54% evaluó con cuatro y 29% con cinco la aproximación de la sensación táctil del modelo físico con la piel. El 50% evaluó con cuatro y 29% con cinco el parecido de la palpación del modelo físico con la zona subclavia. En promedio calificaron con cuatro las características del mismo del modelo físico, lo que sugiere aceptación a los materiales usados para simular la piel en el procedimiento de AVC en pediatría.
5. CONCLUSIONES
Se realizó un modelo escalado 10:1, por la complejidad que implica de realizar un modelo a una escala 1:1 para este tipo de pruebas iniciales por los diámetros de las mangueras de silicona de grado médico.
Se encontró que la silicona de platino tiene la facilidad de ser puncionada en varias ocasiones sin que se rompa el material, por su capacidad de autosellado, lo que permite múltiples punciones. Además puede ser pigmentada para dar un mayor grado de realismo visual.
El modelo obtenido tiene características similares a las descritas acerca del tejido, el espesor de las capas es consistente con lo encontrado en la literatura en una escala 10:1. La sensación al tacto es similar a la piel, aunque carece de características como la temperatura corporal o el pulso sanguíneo en la arteria cercana a la vena.
6. AGRADECIMIENTOS
Este proyecto fue parcialmente financiado por la Vicerrectoría de Investigaciones de la Universidad Militar Nueva Granada, proyecto ING1530.
7. REFERENCIAS
7.
[1] Rao, S. y Hogan, M. J. (2010). Transbrachial access for radiologic manipulation of problematic central venous catheters in a pediatric population. Cardiovascular and interventional radiology, 33 (4), 756–759.
[2] Walser, E.M. (2012). Venous access ports: indications, implantation technique, follow-up, and complications. Cardiovascular and interventional radiology, 35(4), 751–764.
[3] Chamorro, L., Plaza, L. D., Valencia, C. P., y Caicedo, Y. (2005). Fortalezas y debilidades en el manejo del catéter venoso central en una unidad de cuidados intensivos neonatales. Colombia Médica, 36(3), 25–32.
[4] Engum, S. A., Jeffries, P., y Fisher, L. (2003). Intravenous catheter training system: Computerbased education versus traditional learning
methods. The American Journal of Surgery, 186(1), 67–74.
[5] Park, J., MacRae, H., Musselman, L. J., Rossos, P., Hamstra, S. J. Wolman, S. y Reznick, R. K. (2007). Randomized controlled trial of virtual reality simulator training: transfer to live patients. The American journal of surgery, 194(2), 205–211.
[6] Vogel, J. J., Vogel, D. S, Cannon-Bowers, J. Bowers, C. A, Muse, K., y Wright, M. (2006). Computer gaming and interactive simulations for learning: A meta-analysis. Journal of Educational Computing Research, 34 (3), 229–243.
[7] Lander, A. y Newman, J. (2013). Paediatric anatomy. Surgery (Oxford), 31 (3), 101–105.
[8] Bastir, M., Martínez, G., Recheis, W., Barash, A., Coquerelle, M., Rios, L., Peña-Melián, Á., Río, F. G., y Higgins, P. O. (2013). Differential growth and development of the upper and lower human thorax. PloS one, 8 (9), e75128. http://dx.doi.org/10.1371/journal.pone.0075128
[9] Corporation, S. (2014). Centralineman system. S. Corporation. 1600 West Armory Way, Seattle, WA 98119. Obtenido de: http://www.simulab.com/product/ultrasoundtrainer s/centralineman-system (noviembre, 2015).
[10] McGee, D. C. y Gould, M. K. (2003). Preventing complications of central venous catheterization. New England Journal of Medicine, 348 (12), 1123–1133.
[11] Franceschi, A. T., y Cunha, M. L. (2010). Adverse events related to the use of central venous catheters in hospitalized newborns. Revista latino-americana de enfermagem, 18(2) ,196–202
[12] Rutter, N. (2003). Applied physiology: the newborn skin. Current Paediatrics, 13(3), 226– 230.
[13] Payne, P. A. (1991). Measurement of properties and function of skin. Clinical Physics and Physiological Measurement, 12(2), 105.
[14] Manschot, J., y Brakkee, A. (1986). The measurement and modelling of the mechanical properties of human skin in vivo the model. Journal of Biomechanics, 19(7), 517–521.
[15] Agache, P., Monneur, C., Leveque, J., y De Rigal, J. (1980). Mechanical properties and young’s modulus of human skin in vivo. Archives of dermatological research, 269 (3), 221–232.
[16] Hendriks, F., Brokken, D., Van Eemeren, J., Oomens, C., Baaijens, F., y Horsten, J. (2003). A numerical-experimental method to characterize the non-linear mechanical behaviour of human skin. Skin research and technology, 9(3), 274– 283.
[17] Pailler-Mattei, C., Bec, S., y Zahouani, H. (2008) Measurements of the elastic mechanical properties of human skin by indentation tests. Medical engineering & physics, 30(5), 599–606
[18] King, A., Balaji, S., y Keswani, S. G. (2013). Biology and function of fetal and pediatric skin. Facial plastic surgery clinics of North America, 21(1), 1–6.
[19] Hill, A. (1938). The heat of shortening and the dynamic constants of muscle. Proceedings of the Royal Society of London. Series B, Biological Sciences, 136–195.
[20] Pérez, B. A. et al. (2014), Simulación de la inserción de una aguja en un tejido con realimentación de fuerza. Universidad Militar Nueva Granada. Obtenido en: http://repository.unimilitar.edu.co/bitstream/10654/ 11556/1/Simulaci%C3%B3n%20de%20la%20inse rci%C3%B3n%20de%20una%20aguja%20en%20 un%20tejido%20con%20realimentaci%C3%B3n% 20de%20fuerza.pdf (marzo 2016)
[21] Sayin, M. M., Mercan, A., Koner, O., Ture, H., Celebi, S. Sozubir, S., y Aykac, B. (2008). Internal jugular vein diameter in pediatric patients: are the j-shaped guidewire diameters bigger than internal jugular vein an evaluation with ultrasound. Pediatric Anesthesia, 18(8), 745–751.
[22] McDowell, R. H. (1961). Properties of alginates. Londres, Inglaterra: Alginate Industries Ltd (2nd Ed.).
[23] Lee, K. Y., y Mooney, D. J. (2012). Alginate: properties and biomedical applications. Progress in polymer science, 37(1), 106–126.
[24] Zdrahala, R. J., y Zdrahala, I. J. (1999). Biomedical applications of polyurethanes: a review of past promises, present realities, and a vibrant future. Journal of biomaterials applications, 14(1), 67–90.
[25] Brydson, J. A. (1999). Plastics materials. Oxford, Inglaterra: Butterworth-Heinemann (7th Ed.).
[26] Cohen, J. C., Koenig, D. W., Kromenaker, F. F., Pilecky, R. C., y Satori, C. P. (2009). Mannequin with more skin-like properties. US Patent No 7 549 866
[27] Zou, J., y Fang, J. (2011). Adhesive polymerdispersed liquid crystal films. Journal of Materials Chemistry, 21(25), 9149–9153.
[28] Steward, P., Hearn, J. y Wilkinson, M. (2000). An overview of polymer latex film formation and properties. Advances in colloid and interface science, 86(3), 195–267.Tamayo, M., y Tamayo. (2007) Metodología de la investigación. México: Editorial Limusa (2da ed.).
[29] Nass, L. I. (1992). Encyclopedia of PVC: Compounding Processes, Product Design, and Specifications. Mishawaka, USA: CRC Press, 3.
[30] Braley, S. (1970). The chemistry and properties of the medical-grade silicones. Journal of Macromolecular Science Chemistry, 4(3), 529–544.
[31] Tamayo M. y Tamayo, “Metodología de la investigación,” Editorial Limusa. 2da Edición. México, 2007
[32] MacDonald, M. G., Ramasethu, J., y RaisBahrami, K. (2012). Atlas of procedures in
Neonatology. Philadelphia, USA: Lippincott Williams & Wilkins (5th ed.).
[33] Ogden, R. (1972). Large deformation isotropic elasticity-on the correlation of theory and experiment for incompressible rubberlike solids. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences, 326(1567), 565–584.
[34] Mahmud, L., Ismail, M., Manan, N., y Mahmud, J. (2013). Characterisation of soft tissues biomechanical properties using 3d numerical approach. Business Engineering andIndustrial Applications Colloquium (BEIAC), IEEE, 801–806
[35] Mooney, M. (1940). A theory of large elastic deformation. Journal of applied physics, 11 (9), 582–592.
[36] Calvo Plaza, F. J. (2006). Simulación del flujo sanguíneo y su interacción con la pared arterial mediante modelos de elementos finitos. Universidad Politecnica de Madrid, Tesis por el título PhD. Obtenido de: http://oa.upm.es/443/1/FRANCISCO_JOSE_CAL VO_PLAZA.pdf (marzo 2016)
[37] Hamburg. G. (2005). Universal material tester, 20kN. Gunt Hamburg. Obtenido en: http://www.gunt.de/static/s3648_1.php (marzo 2016)
[38] Caruselli, M., Carboni, L., Franco, F., Torino, G., Camilletti, G., Piattellini, G., Giretti, R., y Pagni, R. (2010). Central venous catheters in neonates: from simple monolumen to port catheter. The journal of vascular access, 12(1), 4–8.