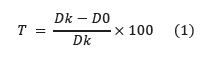
ARTÍCULOS
Fusarium oxysporum PATÓGENO TRANS–REINO, INHIBIDO POR LA HEMOLINFA DE LARVAS DE Galleria mellonella
Fusarium oxysporum TRANS–KINGDOM PATHOGEN INHIBITED BY Galleria mellonella LARVAE HEMOLYMPH
Amalia Muñoz Gómez1, Mauricio Corredor2, Carlos Peláez3
1 Química Farmacéutica, M.Sc., Estudiante de doctorado, Facultad de Química Farmacéutica, Grupos de Investigación: GIEM, GEBIOMIC, GABi, amalia.munoz@udea.edu.co
2 Biólogo, M.Sc., Ph.D., Profesor Asociado, Grupos de Investigación GEBIOMIC, GRC Facultad de Ciencias Exactas y Naturales, Instituto de Biología, mauricio.corredor@udea.edu.co
3 Biólogo, Máster, Doctor en Ciencias Químicas. Profesor Asociado, Facultad de Ciencias Exactas y Naturales Instituto de Química, Grupo de Investigación: GIEM, directorgiem@yahoo.com Universidad de Antioquia, Calle 67 No. 53 – 108, Medellín, Colombia
Recibido: 15 de Abril de 2014. Aceptado: 30 de Junio de 2014.
RESUMEN
Con el propósito de validar el modelo de inhibición de crecimiento in vitro del hongo patógeno Fusarium oxysporum se trataron con él larvas de Galleria mellonella. La hemolinfa de larvas sobrevivientes a la inyección de 104 y 106 conidias/mL del hongo, durante 48 horas a 37°C, fue extraída e incorporada a medio PDA para cultivo de hongos, con el fin de evaluar la capacidad de la hemolinfa de inhibir el crecimiento del hongo. Las pruebas estadísticas demostraron que las hemolinfas retadas inhibieron el crecimiento del hongo, indicando que los lípidos y proteínas; principales constituyentes de la hemolinfa inmunizada, continúan activos, impidiendo el crecimiento normal del hongo. La normalidad, independencia y homogeneidad de los datos mostraron la rigurosidad del diseño experimental. El presente estudio contribuye a consolidar a G. mellonella, como una herramienta para estudios de patogenicidad de este hongo, capaz de atravesar la barrera de los reinos biológicos.
Palabras clave: Fusarium oxysporum, Galleria mellonella, Hemolinfa
ABSTRACT
In order to validate the model for in vitro growth inhibition of the fungal pathogen Fusarium oxysporum, larval hemolymph of the Galleria mellonella was used. Hemolymph of surviving larvae after being challenged with injection of 104 and 106 conidia/mL from F. oxysporum and incubated at 37°C for 48 hours, was extracted and incorporated into PDA fungal media, with the aim to evaluate the ability of the hemolymph for inhibiting fungal growth. Statistical tests showed that the challenged hemolymph inhibited the growth of the fungus, indicating that the lipids and proteins, main constituents of immunized hemolymph, remain active and prevent the normal growth of the fungus. Normality, independence and homogeneity of the data showed the rigor of experimental design. This study contributes to consolidate G. mellonella as a tool for studying the pathogenicity of this fungus, capable to cross the barrier of the biological kingdoms.
Key words: Fusarium oxysporum, Galleria mellonella, Hemolymph
1. Introducción
Fusarium oxysporum es un patógeno de importancia económica, que infecta a más de 100 especies de plantas [1], monocotiledóneas y dicotiledóneas [2] en diversos nichos ecológicos en todo el mundo [3, 4]. Se conocen F. oxysporum patógenos y no patógenos que no pueden ser distinguidos morfológicamente [5]. Los miembros patógenos están divididos en aproximadamente 120 formas especiales (formae speciales) de acuerdo a la planta hospedante a la que cause la enfermedad, [2, 6, 7, 8] invadiendo las raíces y causando enfermedades de marchitamiento a través de la colonización de los tejidos del xilema [2]. Las formas no patógenas son mucho más diversas [9, 10]. Tanto los F. oxysporum patógenos como los no patógenos infectan las raíces de plantas, pero los no patógenos están a menudo limitados al córtex donde sobreviven como hongos endofíticos en raíces de plantas, o como saprófitos en la rizósfera o en la materia orgánica del suelo [11]. El hongo patógeno puede crecer como saprófito sobre muchas plantas no hospedantes, dicha sobrevivencia saprofítica contribuye a la longevidad del patógeno en el suelo, por esta razón se cuestiona su especificidad y su utilización como biocontrolador [12]. F. oxysporum es un hongo ascomyceto considerado cosmopolita [1], ubicuo [13] y trans–reino [14, 15]. La capacidad de este hongo para atravesar la barrera de los reinos se evidencia en el estudio de Ortoneda et al. 2004 [16], donde se estableció que un solo aislado de F. oxysporum f. sp. lycopersici, causó enfermedad tanto en plantas de tomate como en ratones inmunodeprimidos.
F. oxysporum es también un patógeno emergente de humanos [17] inmunocomprometidos y otros mamíferos [16], F. oxysporum complejo y F. solani complejo son las especies más frecuentemente aisladas a partir de muestras de laboratorio clínico [15, 17, 18, 19, 20], llegando a constituir en algunos centros, la segunda causa más frecuente de infección por hongos filamentosos después de Aspergillus sp. [18, 21]. Rabodonirina et al. 1994 [22], plantearon que especies de Fusarium consideradas previamente habitantes del suelo y contaminantes del laboratorio, han emergido con significancia en pacientes inmunosuprimidos, en los cuales se presenta una alta mortalidad [21]. F. oxysporum se ha relacionado específicamente con infecciones de piel, meninges, sangre, cerebro, esófago, ano, recto y paladar duro [22] Las infecciones en humanos pueden ir desde superficiales o localmente invasivas, a la fusariosis diseminada, dependiendo de la respuesta inmune del individuo [17, 18, 19, 23]. Aislados patogénicos de F. oxysporum en humanos tienen orígenes polifiléticos y responden mal a los agentes antifúngicos disponibles [18, 24]. La disponibilidad de herramientas moleculares como la eliminación o disrupción de genes específicos (genes knockout) [11], o mutagénesis insercional aleatoria [25] así como la liberación de la secuencia completa del genoma [3], hacen de F. oxysporum un modelo ideal para estudiar las bases genéticas de la patogenicidad de hongos trans–reino [15].
Una limitación en el estudio de la patogénesis de Fusarium spp. es la disponibilidad de hospederos apropiados para investigar la virulencia de hongos. Dos modelos de ratón han sido desarrollados para Fusarium spp. [26], sin embargo, las cuestiones éticas y los gastos asociados a utilizar estos modelos, puede impedir su uso en el laboratorio. Para evitar estos problemas, las larvas de lepidóptero Galleria mellonella (L. pyralidae), se han desarrollado como un modelo hospedero para investigar la virulencia de Fusarium. Este insecto ha servido como modelo anfitrión para otros hongos patógenos de importancia clínica [27, 28], incluyendo Aspergillus [29, 30]. Es importante destacar que en estos hongos clínicamente importantes, muchos de los factores de virulencia, que se requieren para infectar mamíferos, también son necesarios para la infección de G. mellonella [28, 31, 32]. Mediante el uso de este sistema biológico insecto–hongo, se ha descubierto que aislamientos clínicos y ambientales de Fusarium matan las larvas a 37°C, aunque la muerte ocurre más rápidamente cuando se incuba a 30°C, sin embargo la muerte es dependiente de otros factores, incluyendo la cepa de Fusarium, la morfología de las conidias y la cantidad inyectada. También se ha encontrado que aislamientos identificados como patógenos de plantas, son capaces de matar larvas de G. mellonella [23].
En el presente trabajo nos interesamos en la interacción entre el huésped animal no vertebrado y el hongo patógeno de plantas y humanos, evaluada a la temperatura fisiológica de mamíferos, la cual nos permitió evaluar estadísticamente tanto la capacidad del huésped para resistir el patógeno fúngico, como la habilidad del hongo para resistir la respuesta inmune del insecto. Para lograr este propósito se utilizó hemolinfa de larvas de G. mellonella retadas con diferentes concentraciones de conidias del hongo, las cuales se colocaron en medio de crecimiento del hongo y se evaluó la capacidad de las muestras de hemolinfa para inhibir el crecimiento y desarrollo de F. oxysporum. El estudio de la interacción huésped–patógeno de estos dos organismos considerados modelo, contribuye a una compresión más cercana de la interacción de los mamíferos con este patógeno fúngico que es capaz de atravesar las barreras de los reinos biológicos.
2. Materiales y Métodos
2.1 Material Biológico
Tres grupos de larvas de G. mellonella criadas en nuestro laboratorio con dieta artificial, con peso corporal entre 230–330 mg y en el último estadío de desarrollo, se infectaron con la cepa de F. oxysporum aislada por el GIEM en campo, certificada por el CIMIC y mantenida en PDA. El primer grupo de larvas se infectó con 1x104 conidias/mL, el segundo grupo, con 1x106 conidias/mL y en el tercer grupo se hizo doble estimulación, primero se pre–inoculó con Lactobacillus plantarum (ATCC 8014), se incubó a 25°C por 24 horas y después se infectó con 1x106 conidias/mL del hongo. Los tres grupos de larvas se incubaron por 48 horas a 37°C, en la oscuridad. Se realizaron los experimentos en tres réplicas independientes [23, 33]. Pasadas las 48 horas, se extrajo la hemolinfa de las larvas retadas y se procesó para obtener hemolinfa libre de hemocitos [34, 35].
2.2 Identificación de las muestras
Las muestras de hemolinfa retada y los controles se denominaron tratamientos y se identificaron como: Control para el control positivo de crecimiento; Fluc (fluconazol) para el control negativo de crecimiento; HF104 para la hemolinfa retada con 1x104 conidias/mL; HF106 para la hemolinfa retada con 1x106 conidias/mL y HBF106 para la hemolinfa inoculada con L. plantarum seguido de inoculación de 1x104 conidias/mL de F. oxysporum.
2.3 Determinación de la actividad antifúngica de la hemolinfa de larvas retadas
Se incorporaron 100 μL de cada una de las muestras de hemolinfa inmune de larvas de G. mellonella en tubos que contenían 20 mL de PDA mantenido a 45°C, para evitar su solidificación. Cada tubo se homogeneizó por agitación manual y se vertió su contenido en cajas de Petri esterilizadas. Se cortaron discos de micelio de 6 mm de diámetro de un cultivo joven del hongo y se inocularon sobre las cajas de forma invertida para que el micelio tuviera contacto directo con el agar. Las cajas se incubaron a 25°C en la oscuridad. Pasados siete días me midieron los diámetros de la zona de crecimiento. Se utilizó un control de crecimiento del hongo en PDA (Control) y un control de inhibición del crecimiento con Fluc (fluconazol) 100 μg/mL. Se determinó el efecto antimicrobiano de las muestras de hemolinfa sobre F. oxysporum, mediante la medición de la tasa de inhibición del crecimiento usando la fórmula de la ecuación (1) [36]:
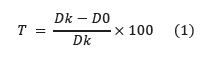
Dk: Diámetro de la colonia de hongos del Control (mm)
D0: Diámetro de la colonia de hongos en presencia de la hemolinfa (mm)
T: tasa de inhibición del porcentaje de crecimiento del micelio
2.4 Recuento de conidias.
Se tomó un área de 5 mm de diámetro de la zona de micelio uniforme de cada uno de los cultivos al décimo día de crecimiento, y se colocó en un tubo esterilizado con 1 mL de agua peptonada, más una gota de Tween–20 y se sonicó durante 30 minutos para asegurar la liberación de conidias. Luego se tomaron 10 μL de cada tubo y se realizó el recuento de conidias con cámara de conteo Neubauer Improved [37].
2.5 Análisis estadístico
Se elaboró un diseño experimental de un sólo factor con efectos fijos, completamente aleatorizado. Se realizó un análisis de varianza de una vía, con su respectiva tabla y se probó la significancia de los efectos de los tratamientos. Se trabajó con α = 0.05. La validación del modelo se llevó a cabo mediante la verificación de los supuestos del modelo y se realizó por tres partes: la normalidad, la independencia y la homogeneidad de la varianza. Primero se realizó el cálculo de normalidad y se graficó la banda de confianza en un gráfico QQplot. Igualmente se efectuó la prueba de Shapiro–Wilk para el cálculo de normalidad con hipótesis Ho: donde los errores tienen distribución normal y H1: donde los errores no tienen distribución normal. Luego se realizó la prueba de Independencia donde se compararon residuales contra índices con la prueba de Durbin–Watson. Para medir la homogeneidad de la varianza (homocedasticidad) se graficaron los residuales versus los ajustados y se verificó con la prueba de Levene para paramétricos, y la prueba de Fligner– Killeen para no paramétricos. Una vez verificados los supuestos, se planteó la prueba F para las medias del crecimiento de las muestras. Finalmente se realizó la prueba de comparaciones múltiples, con la prueba de Dunnett. Para todo el análisis del modelo se utilizó el paquete estadístico R [38] versión 3.1.0.
3. Resultados
3.1 Actividad anti–fúngica de la hemolinfa de larvas retadas
Se determinó cuantitativamente la actividad antimicrobiana de las muestras de hemolinfa y de los controles, mediante la evaluación de la tasa de inhibición, como se observa en la figura 1A. El gris oscuro, representa el porcentaje de crecimiento del hongo y el gris claro, indica la inhibición que produjeron las muestras de hemolinfa y el fluconazol sobre el crecimiento de F. oxysporum. La muestra de hemolinfa HBF106 presentó mayor inhibición del crecimiento del hongo, seguida de HF106 y HF104 presentó la menor inhibición de las tres muestras de hemolinfa retadas.
3.2 Recuento de conidias.
El recuento de conidias pasados diez días de desarrollo de F. oxysporum en PDA, con las diferentes muestras de hemolinfa y los controles se muestra en la figura 1B. Se observa descenso de la concentración de conidias de izquierda hacia derecha.
3.3 Análisis estadístico
El análisis de varianza de la figura 2A, muestra el diagrama de cajas y bigotes (boxplot) para los datos. Ningún boxplot presenta valores extremos. También se observa que las muestras de hemolinfa presentan distribuciones cuya mediana es diferente de la mediana del Control (control positivo) y del control negativo Fluc (fluconazol).
Verificación de los supuestos del modelo (con un nivel de significancia de α = 0.05): los supuesto de normalidad: de la figura 2B, muestra el gráfico Cuantil–Cuantil (QQ–plot) con IC95%, se observa que los residuales están concentrados alrededor de la recta de igualdad de cuantiles. Con el test de Shapiro–Wilk, se obtuvo un valor–p = 0.2541 < 0.05 que indicó normalidad.
Supuesto de independencia: la figura 2C muestra la gráfica de Residuales vs Índices, no se observan tendencias ni patrones, y los residuales están distribuidos homogéneamente alrededor del cero. Con la prueba adicional de Durbin–Watson, se obtuvo un valor–p = 0.1329 > 0.05 que indicó que los datos eran independientes.
Supuesto de homocedasticidad: la figura 2D muestra la gráfica de Residuales vs Ajustados, donde se aprecia variabilidad en los residuales de HF104; se observa menor dispersión en HBF106, mientras que en HF106 no se presenta dispersión. Con las dos pruebas adicionales para verificar homocedasticidad se obtuvieron valores–p menores que 0.05, Levene (valor–p = 0.5271) y Fligner– Killeen (valor–p = 0.4933) Los valores–p indicaron homogeneidad de varianza en los errores.
La prueba F para las medias del crecimiento de los tratamientos, indicó que todas las medias fueron diferentes y por lo tanto los efectos de los tratamientos fueron significativos. Se construyó la tabla ANOVA, con un nivel de significancia de α = 0.05, obteniéndose un valor–p < 0.01, que confirmó que los efectos de los tratamientos no fueron nulos.
Con la prueba de comparaciones múltiples de Dunnett (figura 4), se comparó la media de crecimiento de cada tratamiento frente a la media de crecimiento del Control positivo, el valor–t (t–value) que se obtuvo fue mayor que el cuantil Q esperado (Quantile = 2.8909). Se concluye que todas las diferencias de medias son estadísticamente significativas a un nivel de significancia de α = 0.05.
El IC95% para cada una de las diferencias de medias respecto al Control positivo (figura 5), muestra que el cero no está en ningún IC95%, lo que confirma que la media de crecimiento de cada tratamiento es diferente a la media de crecimiento del control positivo (figura 6).
4. Discusión
4.1 Actividad anti–fúngica de la hemolinfa de larvas retadas
Una alternativa para el estudio del versátil patógeno fúngico, F. oxysporum, es otro organismo igualmente adaptable: G. mellonella, que gracias a su eficaz respuesta inmune innata, ofrece varias ventajas, entre ellas, desarrollarse a temperaturas en los límites de 25 a 37°C. La posibilidad de estudiar patógenos a 37°C, permite el estudio de rasgos de virulencia relacionados con la temperatura. Las larvas son fácilmente inoculadas por inyección, lo que permite entregar una cantidad exacta de células fúngicas, que es más ventajoso que el método alimenticio de inoculación usado con otros huéspedes no mamíferos. La hemolinfa de G. mellonella posee un complejo sistema celular (hemocitos), que desempeña un papel fundamental en la defensa contra patógenos fúngicos. [33, 39, 40]. Además, la talla relativamente grande de estas larvas las hace más fáciles de manejar y convierte a Galleria en un modelo atractivo de usar, cuando se requieren inyecciones repetidas de microorganismos o de compuestos antimicrobianos.
Los volúmenes grandes de hemolinfa de las larvas, facilitan los análisis bioquímicos, y el hecho de que puedan ser incubados a 37°C, en última instancia, los califica como modelos más exactos de interacción [32, 33]. F. oxysporum se caracteriza por producir colonias de rápido crecimiento, con una tasa diaria cercana a un centímetro en medio agar papa dextrosa a 25°C [1], por lo tanto el método de contacto directo permitió la cuantificación de la actividad de la hemolinfa. La muestra de hemolinfa procedente de larvas inoculadas previamente con la bacteria láctica L. plantarum, con posterior infección con 106 conidias/mL de F. oxysporum (figura 1A), presentó el mayor porcentaje de inhibición; de todas las muestras de hemolifa en tanto que la muestra que causó menor inhibición fue la hemolinfa retada con 104 conidias/mL. El empleo de la bacteria láctica sirve para estimular la respuesta inmune de las larvas previamente a la infección fúngica, como lo realizan los estudios de Begin et al. 2006 [33], quienes demostraron que la pre–exposición de larvas de G. mellonella a Saccharomyces cerevisiae aumentó su respuesta inmune frente a la infección con Candida albicans. Se encontró igualmente que el fluconazol causó un efecto fungistático en la cepa de F. oxysporum aislada de suelo, puesto que al inicio del ensayo (datos no mostrados), se inhibió el crecimiento del hongo, sin embargo pasados tres días el hongo creció, pero en menor proporción que el control positivo de crecimiento, debido a la concentración del fluconazol empleada.
4.2 Recuento de conidias.
En la figura 1B, al comparar las muestras de hemolinfa con reto fúngico tanto con el Control de crecimiento (máximo recuento de conidias) como con el control de inhibición Fluc (mínimo recuento de conidias), se encontró el mayor número de conidias/ mL en HF104, el número de conidias disminuyó en HF106, y fue menor en HBF106 se observa una relación inversamente proporcional al porcentaje de la inhibición producido por las diferentes muestras de hemolinfa con reto fúngico, es decir, a mayor inhibición del hongo, menor recuento de conidias por mL. La cantidad de conidias por mL es directamente proporcional al porcentaje de crecimiento del hongo.
4.3 Significancia estadística
El diagrama de cajas y bigotes (boxplot) de la figura 2A para el análisis de varianza mostró, que ningún boxplot presentó valores extremos. El boxplot Control (control positivo) evidenció una distribución con valores de crecimiento muy altos, lo que es consecuente con que el hongo no tiene ningún agente antimicrobiano que lo haya inhibido; el caso contrario se observó en el boxplot de Fluc (control negativo), en donde el hongo creció muy poco por efecto del antimicótico. Respecto a los tratamientos, se observó que se presentó muy poca variabilidad en HF106 y HBF106, lo que indica un efecto de inhibición del crecimiento casi constante, aunque HBF106 se presenta con valores menores, como efecto de la inoculación previa con la bacteria láctica, desencadenando una mayor actividad antimicrobiana en la hemolinfa y limitando el crecimiento del hongo. El tratamiento HF104 es el que presentó mayor variabilidad, lo que coincide con el hecho de que ésta hemolinfa presentó la menor actividad antimicrobiana.
Evaluación del modelo estadístico: considerando que se tiene un sólo factor el cual fue el crecimiento del hongo, con 5 tratamientos (muestras y controles), y que en cada uno de éstos se tienen 3 observaciones, se puede decir que el diseño fue balanceado. Se observó que el crecimiento (en mm/día) es función de una media global, también del efecto asociado a cada uno de los tratamientos, los cuales son significativos y de un error aleatorio normal no controlable pero minimizado.
Verificación de los tres supuestos del modelo (se empleó con un nivel de significancia de α = 0.05):
i– Supuesto de normalidad: ''los errores fueron normales e idénticamente distribuidos''.
En el gráfico Cuantil–Cuantil (QQ–plot) con su banda de confianza de 95%, mostrado en la figura 2B, se observó que los residuales están concentrados alrededor de la recta de igualdad de cuantiles y no se observaron colas pesadas, lo cual es indicativo de normalidad. Adicionalmente se realizó el test de Shapiro–Wilk, cuya hipótesis nula fue Ho: los errores tienen una distribución normal, obteniéndose un valor–p = 0.2541 siendo menor de 0.05, por lo tanto no se rechaza Ho, es decir, se concluye que los errores del modelo estuvieron normalmente distribuidos.
ii– Supuesto de independencia: ''los datos son independientes''.
La figura 2C corresponde a la gráfica de Residuales vs Índices, en la que no se observó tendencias ni patrones, y se ve que los residuales estuvieron distribuidos casi homogéneamente alrededor del cero, lo que indica que los datos muestrales fueron tomados aleatoriamente. Así, podemos concluir que el supuesto de independencia se cumplió y esto se debió a que se hizo una adecuada aleatorización para llevar a cabo el experimento. Adicionalmente se realizó el test de Durbin–Watson, cuya hipótesis nula fue Ho: la autocorrelación de los datos es igual a cero y la hipótesis alternativa fue Ha: la autocorrelación de los datos es diferente de cero (lo que por la normalidad de los errores implica que los datos son independientes), donde se obtuvo un valor–p = 0.1329 que es mayor de 0.05, lo cual indica que no se rechaza Ho, es decir, concluimos que se considera que los datos fueron incorrelacionados, y por tanto los datos fueron independientes.
iii– Supuesto de homocedasticidad: ''existe homogeneidad de varianza en los errores''.
La figura 2D muestra la gráfica de Residuales vs Ajustados, en la que se observó que no se presentó variabilidad en los residuales de HF106, y que se presentó menor dispersión en los residuales de HBF106, aunque no fue muy distinta a la presentada por los otros tratamientos, lo que indicó que hubo homogeneidad en la varianza. Adicionalmente se realizaron dos pruebas para verificar homocedasticidad, cuya hipótesis alternativa fue Ha: existen al menos dos muestras con varianza diferente, una paramétrica (prueba de Levene, valor–p = 0.5271) y una no paramétrica (prueba de Fligner–Killeen, valor–p = 0.4933). Los valores–p menores que 0.05 indicaron que no se rechaza Ho, es decir, concluimos que se presentó homogeneidad en la varianza en los errores.
Una vez verificados los supuestos, se planteó la prueba F para las medias del crecimiento de los tratamientos, la cual fue Ho: las medias de crecimiento de todos los tratamientos son iguales, y Ha: existen al menos un par de tratamientos con medias de crecimiento distintas, que sería los mismo que decir que en Ho: todos los efectos de los tratamientos son iguales y nulos y Ha: existen al menos un tratamiento con efecto no nulo. Se valida que todas las medidas de crecimiento fueron diferentes y que los efectos de los tratamientos no fueron nulos.
Se procedió a construir la tabla ANDEVA, Figura 3 (o ANOVA, por sus siglas en inglés) con un nivel de significancia de α = 0.05, en donde vemos que el valor–p < 0.01, lleva a rechazar Ho, concluyéndose que a un nivel de significancia de α = 0.05 los efectos de los tratamientos no fueron nulos, es decir fueron significativos, dicho de otra forma, las medias de crecimiento en cada tratamiento fueron distintas para al menos una pareja de tratamientos.
Posteriormente se realizó la prueba de comparaciones múltiples de Dunnett (figura 4), la cual se debe utilizar cuándo se pretende comparar los tratamientos con un control, como fue nuestro caso. Se observó que al comparar la media de crecimiento de cada tratamiento frente a la media de crecimiento del Control positivo, el valor–t (t–value), en valor absoluto, fue mayor que el cuantil Q esperado (Quantile = 2.8909), por lo tanto todas las diferencias de medias resultaron ser estadísticamente significativas a un nivel de significancia de α = 0.05, lo cual fue confirmado por los valores–p < 0.01. Además, los signos negativos de los valores de diferencias de media estimados confirmaron que el promedio de crecimiento del control fue el más alto de todos los tratamientos.
Se calculó además el IC95% para cada una de las diferencias de medias respecto al Control positivo (figura 5). Se observó que el cero no estuvo incluido en ningún IC95%, lo que confirma que la media de crecimiento de cada uno de los tratamientos del hongo fue diferente a la media de crecimiento del control positivo de crecimiento del hongo, como se observó en la figura 6.
5. Conclusiones
Los extractos de hemolinfa inmunizada de G. mellonella, por reto fúngico producen inhibición in vitro del crecimiento de F. oxysporum en medio clásico para hongos (PDA), aun tratándose de muestras crudas de hemolinfa, es decir, sin ningún tipo de tratamiento posterior a la extracción y que se encuentran en el medio PDA bastante diluidas, estas hemolinfas impiden el normal crecimiento del hongo.
El análisis de varianza, la evaluación de supuestos, las pruebas de Dunnett y F, de los datos de diámetros tomados al día 7, y la homogeneidad o poca dispersión de las medias, nos permiten concluir, que los ensayos de inhibición fueron consistentes y que el valor de inhibición fueron significativos. De esta forma esta investigación permite encarar un estudio más complejo que incluya dosis dependencia y concentración mínima inhibitoria.
El presente estudio contribuye a consolidar el modelo patógeno–huésped entre F. oxysporum y G. mellonella, como una herramienta para estudios de patogenicidad de hongos trans–reino. Los resultados y los análisis estadísticos muestran que el modelo es equilibrado y reproducible.
Ensayos previos in vivo, mostraron que G. mellonella sobrevive el ataque del hongo hasta 106 conidias/mL, y la posibilidad de que los extractos de hemolinfa funcionen fuera del organismo, abre una perspectiva frente al estudio del control del patógeno trans–reino F. oxysporum.
6. Agradecimientos
Al posgrado de Química Farmacéutica de la Universidad de Antioquia. Al fondo de Estrategia de Sostenibilidad 2011–2012, para el grupo GIEM de la Vicerrectoría de Investigaciones de la Universidad de Antioquia. A Diego Chávez por su valiosa ayuda con el manejo del paquete R y el análisis estadístico.
7. Referencias
[1] Bosland, P.W. Fusarium oxysporum a pathogen of many plant species, Adv. Plant Pathol., 6, 281– 289, 1988.
[2] Armstrong, G.M. y Armstrong, J.K. Formae speciales and races of Fusarium oxysporum causing wilt diseases En: Fusarium: Diseases, Biology and Taxonomy (Eds. P.E Nelson, T.A. Toussoun y R.J. Cook), Penn State University Press, University Park, reading 391–399, 1981.
[3] Ma, L–J., van der Does, H.C., Borkovich, K.A., Coleman, J.J., Daboussi, M–J., et al. Comparative genomics reveals mobile pathogenicity chromosomes in Fusarium, Nature, 464, 367–373, 2010.
[4] Gordon, T. y Martyn, R. The evolutionary biology of Fusarium oxysporum, Annu. Rev. Phytopathol., 35, 111–128, 1997.
[5] Correl, J.C. The Relationship Between Formae Speciales Races and Vegetative Compatibility Groups in Fusarium oxysporum, Phytopathology, 81, 1061–1064, 1991.
[6] Booth, C. The present status of Fusarium taxonomy, Annu. Rev. Phytopathol., 13, 83–9, 1975.
[7] Bosland, P.W. y Williams, P.H. An evaluation of Fusarium oxysporum from crucifers based on pathogenecity, isozyme polimorphism, vegetative compatibility and geographical origin, Can. J. Bot., 65, 2067–2073, 1987.
[8] Kistler, H.C. Genetic diversity in the plantpathogenic fungus Fusarium oxysporum, Phytopathology, 87, 474–479, 1997.
[9] Gordon, T.R. y Okamoto, D. Population structure and the ralatioship between pathogenic and nonpathogenic strains of Fusarium oxysporum, Phypathology, 82, 73–77, 1992.
[10] Lori, G., Edel–Hermann, V., Gautheron, N. y Alabouvette, C. Genetic diversity of pathogenic and non–pathogenic populations of Fusarium oxysporum isolated from carnation fields in Argentina, Phythopatology, 94, 661–668, 2004.
[11] Di Pietro, A., García–Maceira, F.I., Méglecz, E. y Roncero, M.I. A MAP kinase of the vascular wilt fungus Fusarium oxysporum is essential for root penetration and pathogenesis, Mol. Microbiol., 39, 1140–1152, 2001.
[12] Garcés de Granada, E., Orozco de Amézquita, M., Bautista, G.R. y Valencia, H. Fusarium oxysporum El hongo que nos falta conocer, Acta Biol. Colomb., 6, 7–26, 2001.
[13] Nelson, P.E., Dignani, M.C. y Anaissie, E.J. Taxonomy, Biology, and Clinical Aspects of Fusarium Species, Clin. Microbiol. Rev., 7, 479– 504, 1994.
[14] van Baarlen, P., van Belkum, A., Summerbell, R.C., Crous, P.W. y Thomma, B.P.H.J. Molecular mechanisms of pathogenicity: how do pathogenic microorganisms develop cross–kingdom host jumps?, FEMS Microbiol. Rev., 31, 239–277, 2007.
[15] Navarro–Velasco, G.Y., Prados–Rosales, R.C., Ortíz–Urquiza, A., Quesada–Moraga, E. y Di Pietro, A. Galleria mellonella as model host for the transkingdom pathogen Fusarium oxysporum, Fungal Genet. Biol., 48, 1124–1129, 2011.
[16] Ortoneda, M., Guarro, J., Madrid, M., Caracuel, Z., Roncero G, M.I., Mayayo, E. y Di Pietro, A., Fusarium oxysporum as a Multihost Model for the Genetic Dissection of Fungal Virulence in Plants and Mammals, Infect. Immun., 72, 1760–1766, 2004.
[17] O'Donnell, K., Sutton, D. a, Fothergill, A., McCarthy, D., Rinaldi, M.G., Brandt, M.E., Zhang, N. y Geiser, D.M. Molecular phylogenetic diversity, multilocus haplotype nomenclature, and in vitro antifungal resistance within the Fusarium solani species complex, J. Clin. Microbiol., 46, 2477–90, 2008.
[18] Nucci, M. y Anaissie, E. Fusarium infections in immunocompromised patients, Clin. Microbiol. Rev., 20, 695–704, 2007.
[19] Tortorano, A.M., Prigitano, A., Dho, G., Esposto, M.C., Gianni, C., Grancini, A., Ossi, C. y Viviani, M.A. Species distribution and in vitro antifungal susceptibility patterns of 75 clinical isolates of Fusarium spp. from northern Italy, Antimicrob. Agents Chemother., 52, 2683–5, 2008.
[20] Zhang, N., O'Donnell, K., Sutton, D., Nalim, F.A., Summerbell, R.C., Padhye, A. y, Geiser, D.M., Members of the Fusarium solani species complex that cause infections in both humans and plants are common in the environment, J. Clin. Microbiol., 44, 2186–2190, 2006.
[21] Olivares C,R., Alfaro L,J., Díaz J,M.C. y Thompson M,L. Fusariosis diseminada por Fusarium oxysporum en un paciente adulto con leucemia mieloide aguda y neutropenia severa febril, Rev. Chil. Infect., 22, 356–360, 2005.
[22] Rabodonirina, M.; Piens, M.A.; Monier, M. F.; Guého, E.; Fiére, D. y Mojon, M. Fusarium infections in immunocompromised patients: case reports and literature, Eur. J. Clin. Microbiol. Infect. Dis., 13, 152–161, 1994.
[23] Coleman, J.J., Muhammed, M., Kasperkovitz, P.V, Vyas, J.M. y Mylonakis, E. Fusarium pathogenesis investigated using Galleria mellonella as a heterologous host, Fungal Biol., 115, 1279–89, 2011.
[24] Azor, M., Cano, J., Gené, J. y Guarro, J. High genetic diversity and poor in vitro response to antifungals of clinical strains of Fusarium oxysporum, J. Antimicrob. Chemother., 63, 1152– 1155, 2009.
[25] Sánchez López–Berges, M. , Di Pietro, A., Daboussi, M.A., Wahab, H.A., Vasnier, C., Roncero, M.I., Dufresne, M. y Hera, C. Identification of virulence genes in Fusarium oxysporum f. sp. lycopersici by large–scale transposon tagging, Mol. Plant Pathol., 10, 95–107, 2009.
[26] Mayayo, E., Pujol, I. y Guarro, J. Experimental pathogenicity of four opportunist Fusarium species in a murine mode, J. Med. Microbiol., 48, 363–366, 1999.
[27] Cotter, G., Doyle, S. y Kavanagh, K. Development of an insect model for the in vivo pathogenicity testing of yeasts, FEMS Immunol. Med. Microbiol., 27, 163–169, 2000.
[28] Mylonakis, E., Moreno, R., El Khoury, J., Idnurm, A., Heitman, J., Calderwood, S.B., Ausubel, F.M. y Diener, A. Galleria mellonella as a Model System To Study Cryptococcus neoformans Pathogenesis, Infect. Immun., 73, 3842–3850, 2005.
[29] St Leger, R., Screen, S. E. y Shams–Pirzadeh. Lack of Host Specialization in Aspergillus flavus, Appl. Environ. Microbiol., 66, 320–324, 2000.
[30] Kavanagh, K. y Reeves, E. P. Exploiting the potential of insects for in vivo pathogenicity testing of microbial pathogens, FEMS Microbiol. Rev., 28, 101–112, 2004.
[31] Brennan, M., Thomas, D.Y., Whiteway, M. y Kavanagh, K. Correlation between virulence of Candida albicans mutants in mice and Galleria mellonella larvae, FEMS Immunol. Med. Microbiol., 34, 153–7, 2002.
[32] Kemp, M.W. y Massey, R.C. The use of insect models to study human pathogens, Drug Discov. Today Dis. Model., 4, 105–110, 2007.
[33] Bergin, D., Murphy, L., Keenan, J., Clynes, M. y Kavanagh, K. Pre–exposure to yeast protects larvae of Galleria mellonella from a subsequent lethal infection by Candida albicans and is mediated by the increased expression of antimicrobial peptides, Microbes Infect. 8, 2105–2112, 2006.
[34] Cytryn;ska, M., Mark, P., Zdybicka–Barabas, A., Suder, P. y Jakubowicz, T. Purification and characterization of eight peptides from Galleria mellonella immune hemolymph, Peptides, 28, 533– 546, 2007.
[35] Wojda, I. y Jakubowicz, T. Humoral immune response upon mild heat–shock conditions in Galleria mellonella larvae, J. Insect Physiol., 53, 1134–1144, 2007.
[36] Bougandoura, N. y Bendimerad, N. Effect Antifongique Des Extraits Aqueux et Methanolique de Satureja calamintha ssp .(Nepeta ) briq, Rev. des BioRessources, 2, 1–7, 2012.
[37] Murillo Arango, W, Acevedo Ruíz, J.M. y Peláez Jaramillo C.A. Fungicidal activity of Eucalyptus tereticornis essential oil on the pathogenic fungus Fusarium oxysporum, Rev. Cub Farm., 45, 264–274, 2011.
[38] R Development Core Team (2008) R: A language and environment for statistical computing, R Foundation for Statistical Computing, Vienna, Austria. ISBN 3–900051–07–0. Disponible en: http://www.R–project.org [consultado en 10 de marzo de 2014].
[39] Fuchs, B.B. y Mylonakis, E. Using nonmammalian hosts to study fungal virulence and host defense. Curr. Opin. Microbiol., 9, 346–51, 2006.
[40] Vogel, H., Altincicek, B., Glöckner, G. y Vilcinskas, A. A comprehensive transcriptome and immune–gene repertoire of the lepidopteran model host Galleria mellonella, BMC Genomics, 12, 308, 1–29, 2011.