ARTÍCULOS
ESTUDIO COMPUTACIONAL DE LA REACTIVIDAD EN COLORANTES TEXTILES DE TIPO INDÓLICO, AZOICO Y ANTRAQUINÓNICO
REACTIVITY OF TEXTILES DYES OF INDOLIC, AZOIC AND ANTRAQUINONIC TYPE
Nancy Montes Valencia1, Eduar A. Tobón Vargas2
1 MSc. en Ciencias–Química, Docente Auxiliar I.U Pascual Bravo, Grupo de investigación Qualipro, Calle 73 No. 73A– 226, email: nmontes@pascualbravo.edu.co
2 MSc. en Ciencias–Química, Docente Municipio de Medellín, email: edutobon78@hotmail.com
Recibido: 07 de Junio de 2013. Aceptado: 14 de Mayo de 2014.
RESUMEN
En el presente artículo se estudió la reactividad teórica de tres tipos de colorantes de uso común en la industria textil: el índigo (1) de la familia indólica, el amarillo disperso 3 (2) de la familia azoica y el azul disperso 3 (3) de la familia antraquinona. Los cálculos computacionales se realizaron con el programa Spartan–Pro para el análisis conformacional de las moléculas. Luego se procedió a la optimización de los confórmeros más estables con el software Gaussian 09 por DFT al nivel de teoría B3LYP/6–31G(d). La reactividad química se orientó al cálculo de propiedades electrónicas obtenidas por medio de las cargas de Mulliken y las superficies de potencial electrostático, encontrándose que el azul disperso 3 posee más sitios reactivos que los otros colorantes, siendo por lo tanto más susceptible de ataques nucleofílicos y electrofílicos.
Palabras clave: colorante, reactividad química, cargas de Mulliken.
ABSTRACT
In this paper the theoretical reactivity of three dyes commonly used in textile industry was studied: indigo (1) from indolic family, yellow disperse 3 (2) from azoic family and disperse blue 3 (3) from antraquinonic family. The computational calculations were carried out with the Spartan–Pro Program for performing conformational analysis. Then, the optimization of the more stable conformers at B3LYP/6–31G(d) level theory with Gaussian 09 program was performed. The chemical reactivity was orientated to the calculation of electronic properties through of Mulliken charges and electrostatic potential surfaces, finding that disperse blue 3 has more reactive sites than the other dyes, being therefore more susceptible to nucleophilic and electrophilic attack.
Key words: dye, chemical reactivity, Mulliken charges.
1. INTRODUCCIÓN
El uso de colorantes ha sido una necesidad del hombre desde tiempos remotos. Se ha reportado que el índigo es originario de la India y su fuente de obtención fue la indigofera tinctoria, utilizado principalmente en el teñido de tejidos y de papiros, convirtiéndose este país en el mayor suministrador de índigo a Europa en la era Greco–Romana [1].
Por su parte, el amarillo disperso 3 es uno de los colorantes dispersos aminobenzoicos más importantes, siendo su principal aplicación el teñido de fibras de poliéster [2]. De forma similar el colorante antraquinónico azul disperso 3 es una especie neutra muy utilizada en el teñido de fibras sintéticas como el poliéster [3].
A partir del siglo XIX, con la síntesis del primer colorante orgánico, comenzó la producción y desarrollo de esta clase de compuestos, observándose que cuando son aplicados a las fibras para dar un color permanente resisten la decoloración causada por el sudor, la luz, el agua y los tratamientos en los procesos de teñido, poseen amplia gama de colores y un menor precio al ser comparados con los colorantes naturales, lo que ha incrementado notablemente su consumo [4], [5].
Se estima que anualmente se producen 700,000 toneladas de colorantes sintéticos los cuales son usados en diferentes sectores como: cuero, cosmética, papel, plástico y textil [6], [7].
A pesar de este hecho, existe una gran preocupación debido a que los colorantes son liberados a las aguas residuales, impactando negativamente a los ecosistemas acuáticos y la salud humana porque son moléculas orgánicas de estructura compleja y son estables a la luz, al calor y a los agentes oxidantes haciendo difícil su remoción [8], [9].
El estudio teórico de la reactividad química se ha basado fundamentalmente en la teoría de funcionales de la densidad (DFT) que es conocida como un eficiente y exacto soporte computacional para el cálculo de estructuras electrónicas [10]. La aplicación de descriptores en DFT ha sido muy exitosa, ya que son de tipo global como: la dureza química, el potencial químico y la electrofilicidad. Estos descriptores también son de tipo local como: funciones de Fukui, suavidad e índices de filicidad que son empleados para describir la selectividad de un sitio en diferentes moléculas [11] y [12]. Este concepto de reactividad química en un colorante es muy importante para entender los procesos de las reacciones químicas y comprender las interacciones que prevalecen en los mecanismos de reacción.
Según revisión bibliográfica son pocas las investigaciones sobre reactividad teórica y computacional de colorantes. Sin embargo se reportan algunos trabajos, uno de estos se centró en los azocolorantes como el amarillo anaranjado y el rojo allura que son utilizados en la industria de alimentos. Se realizó una descripción cualitativa de la reactividad química y estabilidad relativa mediante el cálculo de descriptores globales de reactividad como el potencial químico, la dureza y el índice de electrofilicidad. Otro descriptor local utilizado fue la función de Fukui calculada únicamente para el ataque nucleofílico debido a la interacción de estos colorantes con especies como el agente reductor ión bisulfito el cual es un conservante adicionado a los jugos de frutas [13].
Otro estudio reportado en la literatura, fue la determinación de la reactividad química teórica de la rodamina B, el cual es un colorante básico de uso extendido en textiles y en alimentos. Se utilizaron descriptores de la reactividad química a través de la teoría de funcionales de la densidad, para calcular la electrofilicidad neta obteniéndose una molécula de naturaleza electrodonante. Otro cálculo realizado fue la función de Fukui nucleofílica encontrándose un solo sitio preferido para ataques nucleofílicos, mientras que no se hallaron sitios activos para el ataque electrofílico [14].
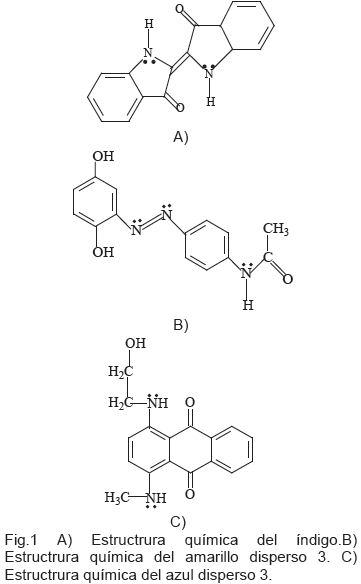
El objetivo de esta investigación fue ampliar el conocimiento sobre la reactividad teórica de colorantes de uso extensivo en la industria textil, de los cuales no se encontraron investigaciones previas: el índigo cuyo sustrato de aplicación es el algodón, el amarillo disperso 3 y el azul disperso 3 que son usados para teñir las fibras de poliéster, los cuales pertenecen a las familias indólica, azóica y antraquinonica, respectivamente. Las fórmulas estructurales se presentan en la Figura 1.
Se aplicó la Teoría de los Funcionales de Densidad (DFT) para determinar parámetros electrónicos, como el análisis de las cargas de Mulliken, método empleado para conocer la densidad electrónica de los átomos en una molécula y por consiguiente entender de forma cuantitativa las zonas donde se acumula carga electrónica y donde hay déficit de la misma [15]. Por tanto se elucidaron los centros más reactivos, es decir los sitios con mayor nucleofilicidad y electrofilicidad, para predecir la reactividad hacia otras sustancias aceptoras o donadoras de electrones que pueden interactuar con los colorantes seleccionados.
2. METODOLOGÍA
Los cálculos se realizaron usando el programa computacional Spartan–Pro [16], para el análisis conformacional de las moléculas. Posteriormente se procedió a la optimización de la geometría del confórmero más estable de cada colorante utilizando el software Gaussian 09 [17] por DFT con el funcional híbrido B3LYP y la base 6–31G(d), esta base se aplicó porque ha sido muy exitosa en la predicción de geometrías para un gran número de reacciones orgánicas [18].
La reactividad química fue evaluada en función del análisis poblacional de Mulliken, que es un método empleado para calcular la distribución de carga en una molécula porque todos sus electrones están asignados a un núcleo y sus resultados se aproximan mucho a los obtenidos cuando se calculan densidades de carga obtenidas de forma rigurosa [15]. Para apoyar los resultados anteriores, se calcularon las superficies de potencial electrostático que sirven para determinar las distribuciones de carga en una molécula, ya que muestran la variabilidad en las regiones cargadas permitiendo identificar los sitios reactivos. El potencial electrostático es una forma cualitativa de conocer la reactividad en una molécula [19].
3. RESULTADOS Y DISCUSIÓN
Las colorantes seleccionadas fueron: el índigo, el amarillo disperso 3 y el azul disperso 3, para los cuales se optimizó su geometría, se calcularon las cargas de Mulliken y se obtuvieron las superficies de potencial electrostático, con el fin de conocer la reactividad de dichos compuestos.
3.1 Análisis de resultados para el colorante índigo
La geometría optimizada se muestra en la Figura 2A), esta molécula es casi plana con presencia de átomos de oxígeno y nitrógeno que la hacen muy polar. La disposición de los sustituyentes en posición trans permite que posean una mayor reactividad porque forman parte de un sistema de enlaces conjugados. En la Figura 2B) se observa la superficie de potencial electrostático, indicando que existe mayor acumulación de cargas sobre los átomos de oxígeno, siendo estos los centros donadores de carga para posteriores reacciones.
En la tabla 1, se indican los valores de las cargas de Mulliken, estos valores señalan que los sitios activos de reacción para adiciones electrofílicas ocurren en los heteroátomos, O–13 y O–22, señalando que las estructuras resonantes no afectan mucho la disponibilidad de los pares electrónicos libres de estos átomos.
3.2 Análisis de resultados para el colorante amarillo disperso 3
En la figura 3A) se presenta la estructura optimizada, observándose una configuración casi plana que le facilitará reaccionar con sustancias aceptoras o donadoras de electrones. En la figura 3B), se muestra la superficie de potencial electrostático, siendo la densidad electrónica mayor para los oxígenos, particularmente para el oxígeno O–7, significando que en este átomo es mayor la probabilidad de que ocurran reacciones del tipo adición nucleofílica.
Los centros aceptores de electrones están localizados en los átomos de carbono del grupo carbonilo, C–8 y C–17, como resultado de la polarización del grupo carbonilo. Los hidrógenos con los mayores valores de las cargas de Mulliken, son H–15 y H–21, lo cual siguiere la formación de puentes de hidrógeno intramolecular con los oxígenos O–22 y O–13, respectivamente. Dicha interacción atómica, puede ocasionar que los carbonos carbonílicos sean más deficientes en carga aumentando su reactividad hacia potenciales ataques de nucleófilos.
Los valores de las cargas de Mulliken, se muestran en la tabla 2, notándose que los centros donadores de electrones son los átomos de oxígeno O–7, O– 27, O–31, el heteroátomo con mayor carácter nucleofílico es el O–7 que hace parte del grupo amido (–NHCOCH3).
El sitio activo de reacción para ataques nucleofílicos es el átomo de carbono C–5, dado que está enlazado a dos átomos más electronegativos que alteran su densidad electrónica.
3.3 Análisis de resultados para el colorante azul disperso 3
La figura 4A) corresponde a la geometría optimizada indicando que el sistema es totalmente plano en los anillos, dicha planaridad de la molécula minimiza los impedimentos estéricos con posibles nucleófilos o electrófilos. En la figura 4B) se aprecia la superficie de potencial electrostático, siendo los átomos de oxígeno los que presentan una densidad de carga negativa más alta.
En la tabla 3, se encuentran los sitios más susceptibles de reacciones electrofílicas los cuales son los átomos de oxígeno O–20, O–21, O–31 y en menor grado el átomo de nitrógeno N–33. Los centros aceptores de electrones están ubicados en los átomos de carbono C–2 y C–7, debido a la polarización de los enlaces que los unen con los átomos N–33 y O–20, respectivamente.
4. CONCLUSIONES
Se realizó un análisis basado en cálculos computacionales, encontrando una reactividad química importante en los tres colorantes estudiados que se relaciona con factores electrónicos y con la geometría molecular. Sin embargo, el azul disperso 3 es el compuesto más reactivo, evidenciado por poseer más sitios susceptibles de adiciones electrofílicas y nucleofílicas, como se observó con las cargas de Mulliken y la superficie de potencial electrostático.
Estudios posteriores incluirán el efecto de varios solventes sobre la reactividad de estos colorantes, así como el efecto de la temperatura sobre la solvatación de dichos sistemas.
5. AGRADECIMIENTOS
Los autores agradecen a la Institución Universitaria Pascual Bravo el apoyo brindado para la obtención de resultados en este trabajo de investigación.
REFERENCIAS
[1] Amat A., Rosi, F., Miliani C., Sgamellotti A., Fantacci S. Theoretical and experimental investigation on the spectroscopic properties of indigo dye, J.M. Struct. , 993, 43–51, 2011.
[2] Seo, J., Joo, W., Choi, G., Ran, M., Yeon, S.,Sung, S. , Sook, J. Single crystal X–ray structure of C.I. Disperse Yellow 3, Dyes Pigments. , 76, 530– 534, 2008.
[3] Salazar R., Brillas, E., Sirés, I. Finding the best Fe2+/Cu2+ combination for the solar photoelectro– Fenton treatment of simulated wastewater containing the industrial textile dye Disperse Blue 3, Appl. Catal. B–Environ., 115–116, 107–116, 2012.
[4] San Andrés, M., Sancho N., de la Roja, J.M. Alquimia: Pigmentos y colorantes históricos, An. Quim., 106(1), 58–65, 2010.
[5] Saratale, R.G, Saratale, G.D., Chang, J.S., Govindwar, S.P. Review: Bacterial decolorization and degradation of azo dyes: A review, J. Taiwan Inst. Chem. Engineer., 42, 138–157, 2012.
[6] Noroozi B., Sorial G., Applicable models for multi–component adsorption of dyes: A review, J. Environ., 25(3) 419–429, 2013.
[7] Mahmoodi, N. M., Salehi, R., Arami, M., Bahrami, H. Dye removal from colored textile wastewater using chitosan in binary systems, desalination, 267, 64–72, 2011.
[8] Rangabhashiyam, S., Anu, N., Selvaraju, N. Sequestration of dye from textile industry wastewater using agricultural waste products as adsorbents, J. Environ. Chem.Eng., 1, 629–641, 2013.
[9] Shahid, M., Ul–Islam, S., Mohammad, F. Review: recent advancements in natural dye applications: a review, J. Cleaner Prod., 53, 310–331, 2013.
[10] Chamorro, E., Duque, M., Pérez, P. Further relationships between theoretical and experimental models of electrophilicity and nucleophilicity, J. Mol. Struct–Theochem., 901,145–152, 2009.
[11] Srivastava, A., Rawat, P., Tandon, P. R.N. Singh. A computational study on conformational geometries, chemical reactivity and inhibitor property of an alkaloid bicuculline with caminobutyric acid (GABA) by DFT, Compu. Theor. Chem., 993, 80–89, 2012.
[12] Parthasarathi, R., Subramanian V., Chattaraj, P.K. Effect of electric field on the global and local reactivity indices, Chem. Phys. Lett. 382, 48–56, 2003.
[13] Ensuncho A.E, López J. M., Juana Robles. Reactividad Química de los Azo Colorantes Amarillo Anaranjado y Rojo Allura mediante Descriptores Globales y la Función de Fukui, Inform. Tecn., Vol., 23 (6), 3–12, 2012.
[14] Glossman, D. Computational Study of the Chemical Reactivity Properties of the Rhodamine B Molecule, Proc. Comput. Sci., 18, 2013, 816 – 825.
[15] Grant G.H, Richards, W.G. Quantum mechanics, charge distribution calculations. En: Computational Chemistry, Oxford Science Publications, 26–31, 1998.
[16] PC Spartan–Pro. Wavefunction, Inc. Irvine, CA, 1999.
[17] Frisch, M. J. et al., Gaussian 09, Revision C.03. Pittsburgh PA., 2009.
[18] Levine, I. Comparación de métodos. En: Química Cuántica, Prentice Hall, 668–670, 2001.
[19] Electrostatic potential maps. Disponible en: http://chemwiki.ucdavis.edu/Theoretical_Chemistry/ Chemical_Bonding/General_Principles/Electrostatic _Potential_maps. [Consultada el 20 de Febrero de 2014].