SINTÁXONES EN LOS HUMEDALES CON INFLUENCIA MARINA EN LA VERTIENTE SUR DE LA SIERRA MAESTRA
Orlando J. Reyes13, F. Acosta-Cantillo13
1Dr. Ciencias Forestales.
2Ing. Forestal.
3Centro Oriental de Ecosistemas y Biodiversidad (BIOECO). Ministerio de Ciencia, Tecnología y Medio Ambiente (CITMA). José A. Saco Nr. 601, esq. Barnada. CP 90 100. Santiago de Cuba, Cuba.
Autor para la correspondencia: joel@bioeco.cu
RESUMEN
En los humedales con influencia marina de la vertiente sur de la Sierra Maestra se refieren sintáxones pertenecientes a cuatro clases, seis órdenes, ocho alianzas y 20 asociaciones aplicando la metodología de Braun Blanquet, de las cuales uno, uno, dos y nueve respectivamente son descritas por primera vez y están contenidas en cinco formaciones vegetales, de las cuales la más prolífica son los manglares.
Palabras clave: Humedales, sintaxonomía, costas, Cuba Oriental.

Recibido: 17 de diciembre de 2022. Aceptado: 17 de febrero de 2023
Received: December 17, 2022. Accepted: February 17, 2023
WETLANDS SINTAXA WITH WATER SEA INFLUENCE IN THE SIERRA MAESTRA`S SOUTH SLOPE
ABSTRACT
By using the Braun Blanquet methodology in the Sierra Maestraʹs south slope, four classes, six orders, eigh alliances and 20 associations wetlands with water sea influence were found, one, one, two and nine was described for the first time. They were in five vegetation types included, in which the mangrove ecosistem was the more prolific.
Key words: Wetlands, sintaxonomy, shore, Eastern Cuba.
Cómo citar este artículo: Reyes, O. J., Acosta-Cantillo, F. (2023). “Sintáxones en los
humedales con influencia marina en la vertiente sur de la Sierra Maestra” Revista Politécnica, 19(37), 83-102.
https://doi.org/10.33571/rpolitec.v19n37a6
- 1.INTRODUCCIÓN
- 2.MATERIALES Y MÉTODOS
- 3.RESULTADOS
- Sesuvio-Rachicallietea Borhidi in Borhidi et al. 1983.
- Borrichio-Rachicallietalia Borhidi in Borhidi et al. 1983.
- Rachicalli-Borrichion Samek 1973.
- Borrichio-Rachicalletum americanae Samek 1973.
- Coccolobetea uviferae Del Risco & Borhidi 1996.
- Coccolobetalia uviferae Samek 1973.
- Coccolobion uviferae Samek 1973.
- Conocarpodo erecti-Coccolobetum uviferae.
- Conocarpodo erecti-Coccolobetum uviferae Reyes 2003.
- Rhizophoro-Avicennietea germinantis Borhidi & Del Risco in Borhidi 1991
- Rhizophoretalia Cuatrecasas ex Reyes 2014.
- Rhizophorion Cuatrecasas ex Reyes 2014.
- Rhyzophoretum manglis
- Avicennio germinantis-Rhyzophoretum manglis.
- Rhyzophoretum manglis Cuatrecasas 1958 in Reyes
- Avicennio germinantis-Rhizophoretum manglis Reyes & Acosta 2007.
- Avicennietalia Borhidi ex Reyes 2014.
- Avicennion germinantis Reyes 2014.
- Avicennietum germinantis.
- Batidi-Avicennietum germinantis.
- Lagunculario racemosae-Avicennietum germinantis.
- Avicennietum germinantis Reyes & Acosta 2003.
- Batidi-Avicennietum germinantis Borhidi & Del Risco in Borhidi 1991.
- Sesuvietosum portulacastri Reyes subass. nov.
- Typicum Reyes subass. nov.
- Lagunculario racemosae-Avicennietum germinantis Peinado et al. 1994
- Thypho domingensis-Avicennion germinantis Reyes all. nov.
- Ludwigio erectae-Typhetum domingensis.
- Melanthero deltoideae-Thyphetum domingensis.
- Spirodelo polyrhizae-Typhetum domingensis.
- Acrosticho danaefoli-Avicennietum germinantis.
- Eleocharito mutatae-Avicennietum germinantis.
- Schoenoplecto americani-Avicennietum germinantis.
- Ludwigio erectae-Typhetum domingensis Reyes & Acosta ass. nov. En esta contribución.
- Melanthero deltoideae-Typhetum domingensis Reyes & Acosta ass. nov. En esta contribución.
- Spirodelo polyrhizae-Typhetum domingensis Reyes & Acosta ass. nov. En esta contribución.
- Acrosticho danaefoli-Avicennietum germinantis Reyes & Acosta ass. nov. En esta contribución.
- Eleocharito mutatae-Avicennietum germinantis Reyes & Acosta ass. nov. En esta contribución.
- Schoenoplecto americani-Avicennietum germinantis Reyes & Acosta ass. nov. En esta contribución.
- Combretalia Borhidi ex Reyes 2014.
- Conocarpodo-Laguncularion (Cuatrecasas 1958) Borhidi in Borhidi 1991
- Conocarpodetum erecti.
- Prosopido juliflorae –Conocarpodetum erecti.
- Conocarpodetum erecti Reyes 2003.
- Prosopido juliflorae–Conocarpodetum erecti Reyes ass. nov. En esta contribución.
- Alternanthero-Prosopidetea juliflorae Reyes cl. nov. En esta contribución.
- Alternanthero-Prosopidion juliflorae Reyes all. nov. En esta contribución.
- Batidi maritimae-Prosopidetum juliflorae.
- Melanthero deltoideae - Prosopidetum juliflorae.
- Batidi maritimae-Prosopidetum juliflorae Reyes & Acosta ass. nov.En esta contribución.
- Melanthero deltoideae - Prosopidetum juliflorae Reyes & Acosta ass. nov. En esta contribución.
- Caesalpinio bonduc-Dalbergietalia ecastophylli Reyes ord. nov. En esta contribución.
- Dalbergion ecastophylli-brownei Reyes 2003.
- Caesalpinio bonduc-Dalbergietum ecastophylli.
- Dalbergietum brownei.
- Cypero-Sesuvietum portulacastri.
- Caesalpinio bonduc-Dalbergietum ecastophylli Reyes & Acosta 2003.
- Dalbergietum brownei Reyes & Acosta 2003.
- Cypero-Sesuvietum portulacastri Reyes & Acosta 2003.
- 4.DISCUSIÓN
- 5.CONCLUSIONES
- 6.REFERENCIAS
La característica esencial de un humedal es la inundación sostenida o recurrente, donde la saturación en la superficie o en sus proximidades produce unas características fisicas, químicas y biológicas que reflejan el tipo de inundación o saturación, produciendo una vegetación higrófila [1].
En los humedales se han estudiado diversos aspectos, entre ellos: formaciones vegetales ([2],[3],[4]), fitocenosis ([5],[6],[7],[8]), protección ([9],[10]).
De los diferentes tipos de humedales cubanos los manglares son los más extensos, pues ocupan alrededor del 5.1 % de territorio y el 26.1 % de la superficie boscosa de este archipiélago ([11],[12]). En la costa Sur de la Sierra Maestra dichos manglares son también los elementos más amplios y entre ellos, el mayor es el de San Miguel de Paradas, situado en la bahía de Santiago de Cuba. Los uverales y el complejo de costa rocosa, como tienen influencia marina directa fueron incluidos en este estudio. El objetivo de este trabajo es aumentar el conocimiento de los sintáxones pertenecientes a los humedales producto de la influencia marina en la costa Sur de la Sierra Maestra, la que constituye una parte importante de Cuba Oriental.
2.1 Descripción de la zona de estudio
Los humedales costeros pertenecientes al piso de bosques y matorrales semideciduos de la Sierra Maestra, donde evolucionan gran parte de estos ecosistemas, presenta condiciones ecológicas típicamente tropicales; el clima es cálido y la temperatura media anual es alrededor de 24oC. La humedad relativa fluctúa entre 80 y 85 %, mientras que la evaporación varía entre 1 500 y 1 900 mm. La precipitación media anual para este territorio es de 800 a 1 200 mm al año [13], existiendo dos períodos bien definidos: uno con una etapa poco lluviosa acusada (noviembre a abril), donde caen entre 300 y 400 mm y otra, la lluviosa (mayo a octubre) en la cual precipitan entre 800 y 1 000 mm.
En la zona estudiada los humedales se presentan generalmente sobre sustratos provenientes del pleistoceno, mioceno y vulcanógeno sedimentarios [14] y sus suelos evolucionan con la influencia del exceso de humedecimiento.
2.2 Metodología
Los inventarios de vegetación (listas, muestras, stands, relevés), con un área mínima entre 100 y 400 m2, se realizaron por el método clásico [15]. La abundancia dominancia se estimó de cada especie en cada estrato de la forma siguiente: 5, cuando cubre 75 % o más del área del inventario; 4, cubre de 50 a 75 %; 3, cubre de 25 a 50 %; 2, cubre de 5 a 25 %; 1, cubre menos del 5 %, “+” con pocos ejemplares aislados y poca cobertura y “r” cuando hay 2 a 3 ejemplares aislados con poca importancia cenológica. La sociabilidad se separó de la abundancia dominancia por un punto. Además se efectuaron observaciones de las condiciones ecológicas: inclinación, suelo y profundidad del agua. La ordenación de los inventarios de vegetación y la separación de los sintáxones se efectuó por métodos fitosociológicos, para la combinación característica se consideraron las especies con grados de presencia V y IV [16] y para las subasociaciones y variantes las combinaciones diferenciales.
La categorización y denominación de los sintáxones se realizó según el Código Internacional de Nomenclatura Fitosociológica [17]. Para nombrar las especies se siguió a [18], corregidas con [19,20], [21] y [22].
Las formaciones vegetales presentes en los humedales influenciados por el agua marina en la Sierra Maestra son las siguientes: Complejo de costa rocosa, Uveral, Manglar, Herbazal halófito y Matorral asociado a manglar. Respecto a las fitocenosis se conformó el siguiente arreglo fitosociológico:
En este complejo de costa rocosa, las plantas enraízaron en las oquedades de las rocas o en las pequeñas concentraciones de arena que se formaron en algunas microdepresiones. No obstante la poca abundancia de Rachicallis americana y la ausencia de Paspalum distachyon Poit., se consideraron dentro de esa fitocenosis (Tabla 1). Conocarpus erectus presenta aquí la forma procumbens. Se encontraron en las costas altas, rocosas, de la formación Jaimanitas y es el primer tipo de vegetación observado a partir del mar. En esta zona se presentaron en las partes llanas, fuera del embate directo de las olas; sin embargo, estuvieron bajo la influencia de la salpicadura del oleaje fuerte, lo que determinó un ecótopo característico [5].
Tabla 1. Borrichio-Rachicalletum americanae Samek 1973.
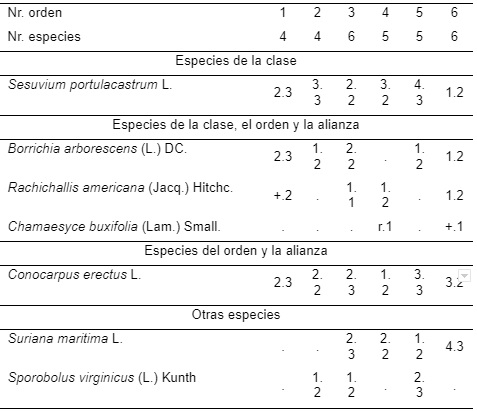
(Typus: Coccolobetalia uviferae Samek 1973).
Este bosque bajo o matorral litoral presentó monodominancia de Coccoloba uvifera. Es generalmente uniestratificada y desarrolló una capa de hojarasca que frecuentemente cubrío todo el suelo. Se observó detrás del complejo de costa rocosa, cuando existío, o directamente frente al mar en dunas arenosas o de costa rocosa. Según Samek [23] esta faja estuvo solo expuesta al oleaje de las perturbaciones ciclónicas, aunque permanentemente a la acción de la salpicadura marina. Se distribuyó por las Antillas, América Central, Bahamas y Florida [23,24].
(Typus: Coccolobion uviferae Samek 1973).
Con las características de la clase.
(Typus: Coccolobetum uviferae (Gleason & Cook 1926) Samek 1973).
Con las características del orden.
Se describió el orden Coccolobetalia uviferae Samek 1973 sin declarar una alianza tipo. Con posterioridad se determinó la clase Coccolobetea uviferae Del Risco & Borhidi 1996 con dicho orden como typus sin considerar la alianza Coccolobion uviferae Samek 1973 como tipo del orden. Aunque los Artículos 5 y 18 del Código exponen que cuando solo existe un sintaxon subordinado de rango principal inmediato inferior se consideró como holotipo, debido a la extensa distribución de estos sintáxones pueden encontrarse nuevas alianzas, por ello fue conveniente ratificar a la alianza Coccolobion uviferae Samek 1973 como typus del orden Coccolobetalia uviferae Samek 1973.
Asociaciones estudiadas.
La formación vegetal fue conocida como Uveral. Consistió en una faja arbórea alargada dominada por Coccoloba uvifera Jacq. Además se declaró como typus el equivalente al inventario 3 de esta Tabla 2. Se presentó cerca del mar, detrás del complejo de costa rocosa, cuando existió, o directamente frente al mar cuando no hay espacio suficiente para el desarrollo de dicha comunidad. Se estudió al Sur de la ciudad de Santiago de Cuba (Reserva Ecológica Siboney Juticí).
Se nombró este sintaxon como Conocarpodo erectae-Coccolobetum uviferae [5], según el Artículo 41 (Correcciones ortográficas) se corrigió como Conocarpodo erecti-Coccolobetum uviferae Reyes 2003.
Tabla 2. Conocarpodo erecti-Coccolobetum uviferae Reyes 2003.
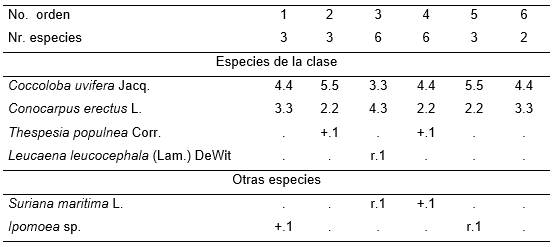
Además: Inv. 3. Canavalia maritima (Aub.) Thons. y Cordia sebestena L. r.1; Inv. 4. Morinda royoc L. y Caesalpinia bonduc (L.) Roxb. r.1.
Asociaciones estudiadas:
(Tabla 3, typus inv. 1.)
Donde el contacto con el mar es muy abrupto, esta comunidad se presentó como una faja entre 2 y 10 m de ancho. En las áreas llanas pudo alcanzar valores mayores. Su altura varió entre 5 y 10 m y su estructura fue más bien continua, sin estratos definidos. La regeneración fue escasa. Esta asociación formó un ecosistema característico, pues se compuso exclusivamente de Rhizophora mangle, el que con su enraizamiento en forma de zancos, creó condiciones especiales para la fijación y desarrollo de diversos tipos de fauna (Tabla 3). El substrato estuvo constituido por sedimentos cuaternarios. Se observó en el borde externo del manglar, directamente en contacto con el oleaje y donde mayor valor alcanzó la variación de la marea.
Tabla 3. Rhizophoretum manglis Cuatrecasas 1956 in Reyes.

En San Miguel de Paradas, bahía de Santiago de Cuba, esta fitocenosis conformó una estrecha faja de hasta 70 m, compuesta solo por Rhyzophora mangle y Avicennia germinans mezcladas (Tab. 4). Generalmente la primera fue más abundante frente al mar, donde formó la mayor parte del estrato arbóreo en los primeros 7 a 15 m; detrás se observaron plántulas en un bosque dominado por la segunda. El estrato arbóreo tuvo entre 10 y 12 m de altura, con una cobertura de alrededor del 90 %, el arbustivo fue casi siempre pobre, entre 5 y 10 %; las plántulas por el contrario cubrieron entre 20 y 50 %. Se denominó como Typus de esta asociación el equivalente en este trabajo al inv. 2, Tabla 4 [25]. Se presentó detrás de Rhizophoretum manglis, o en contacto directo con el mar; por ello, recibió junto con la anterior fitocenosis la influencia más intensa de las mareas y la mayor profundidad del agua; dicha altura del agua fue en ciertas épocas cuando menos de 20 a 30 cm en la marea baja.
Tabla 4. Avicennio germinantis-Rhizophoretum manglis Reyes & Acosta 2007.
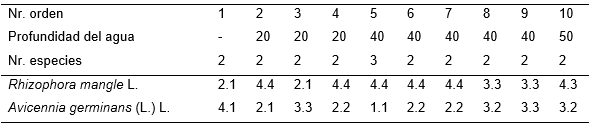
Además, Inventario 5. Laguncularia racemosa (L.) Gaertn. 1.1.
Asociaciones encontradas:
Esta asociación se encontró en toda el área de estudio y generalmente fue la predominante; se halló detrás de Rhizophoretum manglis o de Avicennio germinantis-Rhizophoretum manglis. Estuvo constituida por poblaciones puras de Avicennia germinans, lo que le imprimió un aspecto característico. En la parte en contacto con Rhizophoretum manglis presentó su mayor altura, pues alcanzó entre 10 y 12 m; detrás, se consideró como manglar achaparrado, ya que solo tuvo entre 3 y 6 m. Es de destacar la gran densidad de pneumatóforos, los que fueron usados a veces como puntos de fijación de algas y animales y sobre los que se pudo caminar con facilidad. Se declaró como typus el equivalente en este trabajo al inv. 3 de la Tabla 5 [5]. Los suelos fueron pantanosos (halomórficos), de sedimentos cuaternarios. Se halló en la zona de fluctuación de la marea y fue afectada en toda su extensión durante la marea alta.
Tabla 5. Avicennietum germinantis Reyes & Acosta 2003.

Presentó un estrato herbáceo de alrededor de 30 cm, donde Batis maritima L. es la especie predominante y tuvo además una gran densidad (100 % de cobertura). El estrato arbustivo fue generalmente muy pobre y estuvo compuesto por Avicennia germinans achaparrado, ocasionalmente llegó a la altura de 4 m (fue más frecuente entre 1 y 2 m) y tuvo una cobertura que fluctuó comúnmente entre 25 y 50 %, aunque a veces solo hubo arbustos aislados.
En San Miguel de Paradas se encuentraron dos subasociaciones, las combinaciones diferenciales se observaron en las Tablas 6 y 7.
(Tabla 6, holotypus inv. 10).
Fue humedecida de forma regular por la marea. En la misma se presentaron tres variantes: Alternanthera halimifolia, Schoenoplectus americanus y típica. La primera se encontró en la parte Suroeste de estos manglares; la segunda y la tercera estuvieron regularmente distribuidas; aunque la variante Schoenoplectus americanus estuvo unos centímetros sobre el nivel del mar más alto que la variante típica, pues se desarrolló donde los cangrejos formaron acumulaciones de suelo.
Tabla 6. Batidi-Avicennietum germinantis sesuvietosum portulacastri Reyes.
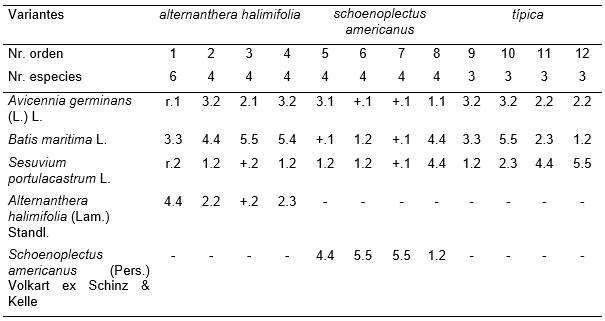
Además: Inv. 1. Opuntia stricta (Haw.) Haw. +1 y Sporobolus indicus (L.) R. Br. r.2.
(Tabla 7, typus inv. 3).
La marea solo intervino elevando el manto freático, por ello la salinidad fue mayor, transicionando al área sin vegetación (saladares), en la que brillaron los cristales de sal. Esta comunidad se presentó sobre sedimentos cuaternarios, en el borde interior de los manglares (límite con los saladares), en lugares donde solo fue humedecida por las grandes mareas altas, y por tanto estuvo fuertemente influenciada por la infiltración del agua marina. Por ello, la salinidad fue muy elevada, lo que limita el número de especies que aquí se desarrollaron.
Tabla 7. Batidi-Avicennietun germinantis subass. typicum.
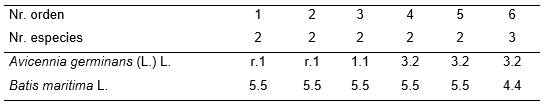
Además: Inv. 6. Prosopis juliflora (Sw.) P. DC. (1.2).
Esta asociación, compuesta por Laguncularia racemosa y Avicennia germinans se encontró muy pobremente representada. A veces se halló separada de Rhizophoretum manglis por marismas de tamaño variable. Alcanzó entre 4 y 10 m de altura y frecuentemente tuvo debajo plántulas de Laguncularia racemosa y/o Avicennia germinans (Tabla 8). Los suelos se inundaron débilmente, se consideró que en algunos lugares solo fue afectada directamente por el agua salada durante las grandes mareas altas y fue también influenciada por el agua de las lluvias.
En el Sur de la Sierra Maestra (Tabla 9, inv. 86) describió como nuevo este sintaxon [5], con posterioridad [25] lo encontraron en el delta del río Cauto (Tabla 6); con esta denominación se creó un homónimo posterior (Artículo 31), pues estaba descrita con dicho nombre [26] y tipificada válidamente [27]. Por tanto debe considerarse como Lagunculario racemosae-Avicennietum germinantis Peinado et al. 1994, ya que tuvo mayor antigüedad.
Tabla 8. Lagunculario racemosae – Avicennietum germinantis Peinado et al. 1994.

Además. Inv. 1. Prosopis juliflora (Sw.) P. DC. r.1.
En esta contribución.
(Holotypus: Eleocharito mutatae-Avicennietum germinantis Reyes & Acosta).
Manglar con dominancia de Avicennia germinans con variadas condiciones ecológicas que producen diversos sintáxones. Tiene una débil influencia de la marea y del agua dulce, en ocasiones se forman pequeñas lagunas someras. Se presenta sobre sedimentos cuaternarios, principalmente provenientes del Grupo El Cobre. El clima es tropical, muy cálido, con lluvias alrededor de 800 mm.
Especies características: Thypha domingensis, Avicennia germinans, Schoenoplectus americanus, Alternanthera maritima, Eleocharis mutata, E. elegans, Bacopa monnieri, Spirodela polyrhiza, Azolla caroliniana, Cyperus giganteus, C. alternifolius y Acrostichum danaefolium.
Asociaciones estudiadas:
(Tabla 9, holotypus inv. 6).
Herbazal de humedal con dominancia de Typha domingensis y donde Avicennia germinans se observa como plántulas. Tiene dos variantes cuyas combinaciones diferenciales se observan en la Tabla 9. Ocupa las lagunas de sustrato fangoso con alrededor de 10 cm de agua en la marea baja, e influencia del agua dulce. Se presenta dentro del manglar en la parte Oeste de San Miguel de Paradas (se estudió 24.04.1993).
Tabla 9. Ludwigio erectae-Typhetum domingensis Reyes & Acosta.
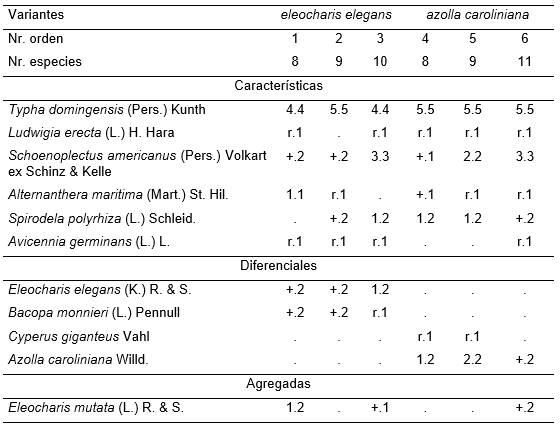
Además: Inv. 3. Mikania micrantha K. r.1.
(Tabla 10, holotypus inv. 2).
Herbazal de humedal con dominancia de Typha domingensis en el estrato superior y Schoenoplectus americanus en el herbáceo (Tabla 10). Se encuentra en lagunas someras de 5 a 10 cm que bordean el manglar de San Miguel de Paradas en su parte Suroeste y tiene influencia del agua de lluvia de los potreros adyacentes (se estudió 24.04.1993).
Tabla 10. Melanthero deltoideae-Typhetum domingensis Reyes & Acosta.
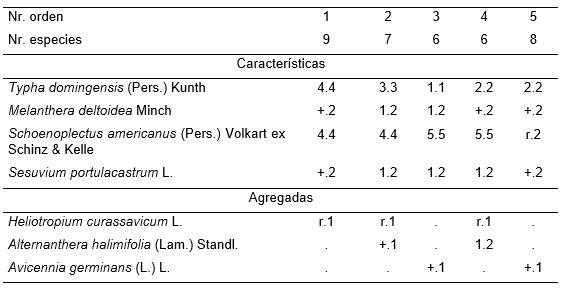
Además: Inv. 1. Batis maritima L., Laguncularia racemosa (L.) Gaertn. y Prosopis juliflora (Sw.) P. DC. r.1; Inv. 2. Sporobolus indicus (L.) R. Br. +.2; Inv. 3. Bacopa monnieri (L.) Pennull +.2; Inv. 5. Cyperus alternifolius L. (+.2), Eleocharis mutata (L.) R. & S. y Ammannia latifolia L. r.1.
(Tabla 11, holotypus inv. 4).
Este sintaxon, se encuentra en zonas algo más profundas que Schoenoplecto americani-Typhetum domingensis, con la que generalmente alterna, es decir, forman una catena en la que define la profundidad del agua. En ambas vicennia germinans no sobrepasa el estadio de plántula pequeña. La combinación característica la componen Typha domingensis y dos especies natantes (Tab. 11). En este sintaxon Typha domingensis presenta vitalidad disminuida y alcanza entre 1.0 y 1.5 m de altura. Se presenta en San Miguel de Paradas en pequeñas lagunas poco profundas, cercanas a tierra firme; el agua, la que por consiguiente tiene influencia del agua dulce, alcanza alrededor de 15 cm por encima del sustrato fangoso (se estudió 25.04.1993).
Tabla 11. Spirodelo polyrhizae-Typhetum domingensis Reyes & Acosta.
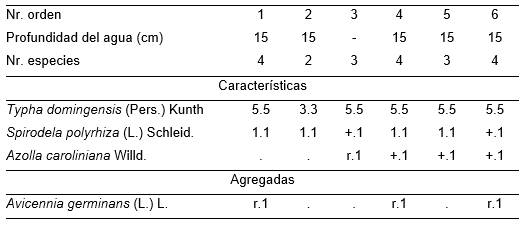
Además: Inv. 1. Cyperus giganteus Vahl r.1.
(Tabla 12, holotypus inv. 5).
Presenta un estrato arbóreo de Avicennia germinans entre 12 y 15 m de altura, con una cobertura de 40 a 70 %. El estrato arbustivo es de Acrostichum danaefolium, que alcanza alrededor de 5 a 6 m y cubre entre 50 y 100 %. Las hierbas solo crecen cuando en el sotobosque ocurren aberturas que permiten la entrada de la luz; si la densidad es muy alta, lo que es frecuente, ellas están ausentes. Las combinaciones características y diferenciales se observan en la Tabla 12. Se encuentran dos subasociaciones: Cyperetosum alternifoli (Typus inv. 3), se halla más cerca de tierra firme y por tanto con mayor influencia del agua dulce; Eleocharitetosum elegantis (Typus inv. 5) está detrás de la anterior, más hacia el interior del manglar, por lo cual es algo más influenciada por la marea, y por tanto con mayor salinidad.
Se estudió (24-28.04. 1993) en el borde Noroeste de los manglares de San Miguel de Paradas, donde desembocan arroyos intermitentes que producen una entrada importante de agua dulce. Debido a la actividad de los cangrejos, el suelo es irregular, con partes hasta cinco centímetros por encima del nivel del agua. Además, por su posición geográfica en el manglar es poco influenciada por las mareas.
Tabla 12. Acrosticho danaefoli-Avicennietum germinantis Reyes & Acosta.
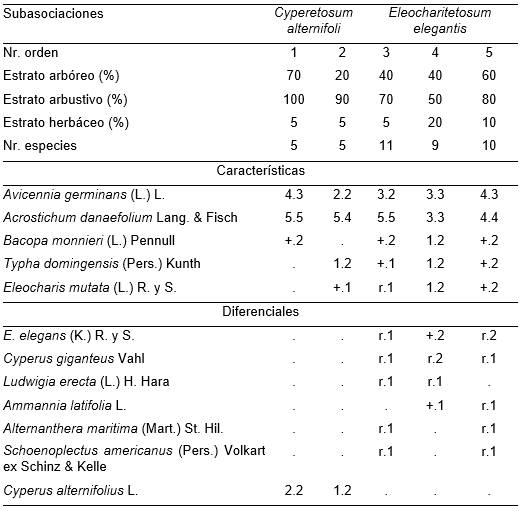
Además: Inv. 1. Mikania micrantha K. 1.2; Inv. 3. Spirodela polyrhiza (L.) Schleid. r.1.
(Tabla 13, holotypus inv. 7).
Frecuentemente se encuentra detrás de Acrosticho danaefoli-Avicennietum germinantis, es decir, le sucede hacia el interior del manglar. A veces, en el estrato arbóreo, además de Avicennia germinans se halla Laguncularia racemosa, alcanzan entre 8 y 14 m de altura y cubren entre 20 y 70 %. El estrato arbustivo es pobre y su cobertura es alrededor del 20 %, excepcionalmente más; el herbáceo por el contrario es denso, fluctuando entre 50 y 80 %. La combinación característica es la más rica de estos manglares (Tab. 13), siendo también la asociación más prolífica en especies. Hay dos subasociaciones: Cyperetosum alternifoli (Typus inv. 3) se halla en la zona más próxima al influjo del agua dulce; la typicum (Typus inv. 7) está sometida en mayor grado que la anterior a las mareas. Se presenta en la parte Noroeste de los manglares de San Miguel de Paradas; el agua, aún con influencia del agua dulce, varía generalmente entre 2 y 10 cm por encima del sustrato (se estudió 22-26.04.1993).
Tabla 13. Eleocharito mutatae-Avicennietum germinantis Reyes & Acosta.
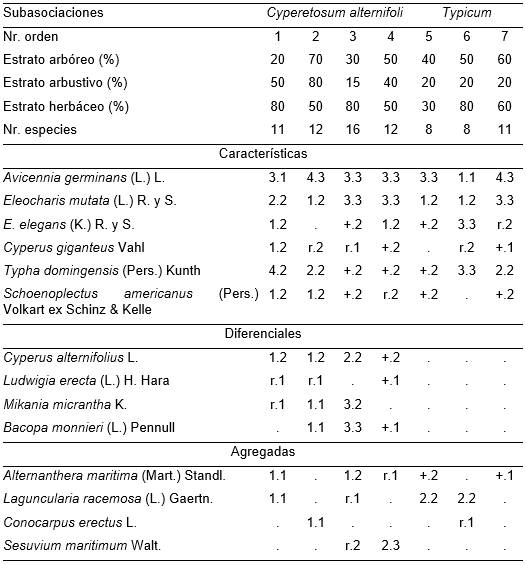
Además: Inv. 2. Ipomoea triloba L. r.1 y Melanthera deltoidea Minch 1.1; Inv. 3. Echinochloa colona (L.) Link. r.2, Pluchea carolinensis (Jacq.) G. Don +.1 y Ageratum sp. r.1; Inv. 4. Acrostichum danaefolium Lang. & Fisch +.1; Inv. 6. Sesuvium portulacastrum L. (+.2); Batis maritima L. r.1; Inv. 7. Ammannia latifolia L. r.1, Spirodela polyrhiza (L.) Schleid. +1 y Azolla caroliniana Willd. 1.2.
(Tabla 14, holotypus inv. 4).
Esta escasa fitocenosis secundaria, se presenta como consecuencia de la destrucción antrópica del manglar de Avicennia germinans en San Miguel de Paradas, sobre todo en los límites exteriores del mismo. Generalmente se observa un estrato herbáceo y solo de forma excepcional algunos ejemplares aislados de la especie expuesta llegan hasta los tres metros.
Se observa en edafótopos donde aún se manifiesta la influencia directa de las mareas altas (se estudió 22-26.04.1993).
Tabla 14. Schoenoplecto americani - Avicennietum germinantis Reyes & Acosta.

Además: Inv. 1. Desmanthus virgatus (L.) Willd. r.1; Inv. 2. Heliotropium curassavicum L. y Sporobolus indicus (L.) R. Br. r.1; Inv. 3. Mikania micrantha K. r.1 y Pluchea carolinensis (Jacq.) G. Don +.1.
Asociaciones estudiadas:
Esta fitocenosis se compone exclusivamente de Conocarpus erectus. No presenta una estratificación definida, sino la estructura es más bien continua. Presenta un 100 % de cobertura y tiene de 8 a 12 m de altura. Conocarpus erectus 5.5. Se estudió en la costa Sur de la Sierra Maestra, ocupa esteros y lagunas interiores, detrás de la duna costera y/o de la faja de Coccoloba uvifera; se ha observado también en la costa Norte de Guantánamo, al Este de la ciudad de Baracoa. El suelo es fangoso de color pardo, con muchos huecos de cangrejos.
Durante su estudio, se denominó este sintaxon como Conocarpodetum erectae [5], debiendo ser corregido de acuerdo al Artículo 41 (Correcciones ortográficas) como Conocarpodetum erecti Reyes 2003.
(Tabla 15, holotypus inv. 3).
Esta asociación, compuesta por Prosopis juliflora y Conocarpus erectus, se observa en el borde interior del manglar, donde se produce la transición a las comunidades contiguas con el mismo. Presenta un estrato arbustivo de 3 a 8 m de altura, con una cobertura entre 30 y 85 % (Tab. 15). El área ocupada por esta fitocenosis, parece que solo durante las mayores mareas equinocsiales es influenciada directamente por el agua marina, pues frecuentemente ocupa lugares más altos que el nivel del resto del manglar. No obstante, es afectada por el agua salina infiltrada y por el agua dulce proveniente de las lluvias y la escorrentía de los campos colindantes. Se estudió 22.01.2000 en la parte Norte de la Bahía de Cabañas.
Tabla 15. Prosopido juliflorae – Conocarpodetum erecti Reyes.
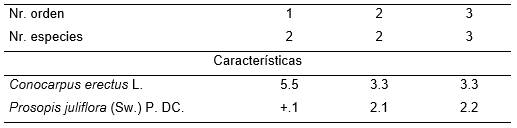
Además. Inv. 3. Vachellia macracantha (Willd.) Seigler & Ebinger r.1.
(Holotypus: Alternanthero-Prosopidetalia juliflorae Reyes).
Comunidades primarias y secundarias, frecuentemente es resultado de la destrucción de los bordes exteriores del manglar y su posterior abandono. Se presenta sobre sedimentos cuaternarios En ocasiones es influenciada subterráneamente por el agua marina y estacionalmente por las precipitaciones. El clima es tropical, muy cálido, con lluvias de 800 a 1 000 mm.
Esta fitocenosis parece ser equivalente a Chrysobalano – Annonetea grabrae Borhidi & Muñiz in Borhidi 1991 en la parte central y occidental del país [33] y a Cappari flexuosae-Bucidetea (Reyes 2008) Reyes 2014 en el Delta del río Cauto [7]; no obstante, por haber sido destruida gran parte de su vegetación original, sobre todo en San Miguel de Paradas, una fracción de esta ha sido invadida por elementos exóticos.
Especies características:Prosopis juliflora, Dalbergia ecastophyllum, D. brownei, Caesalpinia bonduc, Batis maritima, Alternathera maritima, A. halimifolia, Opuntia stricta, Melanthera deltoidea y Sesuvium portulacastrum.
(Holotypus: Melanthero deltoideae-Prosopidetum juliflorae Reyes & Acosta).
Con las características del orden.
Asociaciones estudiadas:
(Tabla 16, holotypus inv. 2).
Es una fitocenosis secundaria, en áreas que fueron manglares y que han sido modificados antrópicamente para convertirlos en pastizales; sin embargo, las especies que el hombre pretendió introducir con ese objetivo no arraigaron. Presenta un estrato arbustivo poco denso, generalmente entre 10 y 30 %, compuesto por Prosopis juliflora (Sw.) P. DC. mientras la cobertura del herbáceo es de 90 a 100 % (Tabla 16). Se halla en suelos que conforman el límite de los manglares y están fuera de la influencia directa de la marea alta. Se estudió el 21.04.1993 en el límite Noreste de los manglares de San Miguel de Paradas.
Tabla 16. Batidi maritimae-Prosopidetum juliflorae Reyes & Acosta.
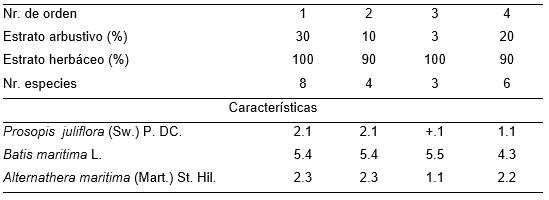
Además. Inv. 1. Avicennia germinans (L.) L. 2.1, Sporobolus indicus (L.) R. Br. r.2; Inv. 2. Cyperus iria L. r.2; Inv. 3. Cissus trifoliata L. r.1; Heliotropium indicum L. r.1, Alternanthera halimifolia (Lam.) Standl. +.1.
(Tabla 17, holotypus inv. 5).
El estrato arbustivo es ralo, generalmente entre 3 y 10 % ocupado por Prosopis juliflora y donde ocasionalmente se encuentra Cordia alba Jacq.; el estrato herbáceo por el contrario tiene una cobertura entre 80 y 100 %. Esta fitocenosis secundaria se observa también en áreas desbrozadas del límite Suroeste de los manglares de San Miguel de Paradas, donde la influencia del agua marina es subsuperficial (se estudió el 20-22.04.1993).
Tabla 17. Melanthero deltoideae - Prosopidetum juliflorae Reyes & Acosta.
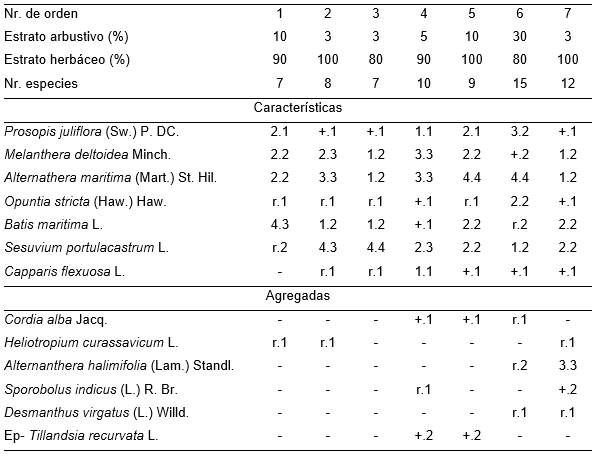
Además. Inv. 6. Vachellia macracantha (Willd.) Seigler & Ebinger r.1, Jatropha gossipifolia L., Gossypium barbadensis L. r.1, Commelina erecta L. y Chloris barbata Sw. +.2; Inv. 7. Bacopa monnieri (L.) Pennull r.1.
(Typus: Dalbergion ecastophylli-brownei Reyes 2003).
Esta comunidad asociada al manglar freuentemente forma una masa alianada con un estrato único y con una densidad tan grande (100 %) que es prácticamente impenetrable para la luz y para las plantas; incluso dificulta extraordinariamente el andar. Se estudió cerca de la desembocadura de los ríos Guamá y Sevilla, fue también observado en la costa norte del municipio Baracoa. Conforma un complejo de ecosistemas de dunas de arena-manglar-humedal de agua dulce.
Especies características: Dalbergia ecastophyllum, D. brownei, Caesalpinia bonduc, Ipomoea alba, Sesuvium portulacastrum, Cyperus tenuis.
Durante su descripción se integró la alianza Dalbergion ecastophylli-brownei Reyes 2003 en el orden Combretalia de la clase Rhizophoro-Avicennietea germinantis [5]. Estudios posteriores ampliaron el areal de esta fitocenosis y determinaron mejor su situación ecológica y de composición florística, considerando que está mejor ubicado en la clase Alternanthero-Prosopidetea juliflorae Reyes cl. nov. por lo que se transfiere para la misma.
Asociaciones encontradas:
La fisonomia de esta fitocenosis se debe a que Dalbergia ecastophyllum (L.) Taub. forma una masa alianada de 4 a 6 m de alto y con una densidad tan grande (100 %), que es prácticamente impenetrable para la luz y para las plantas; incluso dificulta extraordinariamente el andar. Es una comunidad pobre en especies. Se designó como typus el equivalente en este trabajo al inv. 4, Tabla 18. Se presenta cerca de la desembocadura de los ríos Guamá y Sevilla, donde se halla un complejo de ecosistemas de dunas de arena (playa)-manglar-humedal de agua dulce. Generalmente se encuentra en la parte interior de la duna de arena, mayormente en áreas más elevadas que el manto freático (hasta 80 cm), con buen drenaje superficial y con suelo arenoso. Ocasionalmente se halla en suelo de manglar, pero donde el agua tiene una profundidad considerable.
Tabla 18. Caesalpinio bonduc-Dalbergietum ecastophylli Reyes & Acosta 2003.
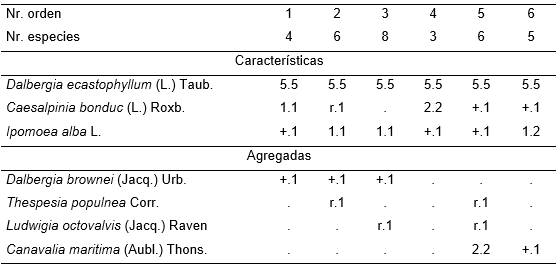
Además. Inv. 2. Guazuma ulmifolia Lam. r.1; Inv. 3. Panicum purpurascens Raddi +.2, Chamaecrista diphylla (L.) Greene +.1, Cyperus tenuis Sw. (r.2), Spilanthes urens Jacq. r.1; Inv. 6. Conocarpus erectus L. 3.2.
Dalbergia brownei (Jacq.) Urb., especie característica, forma un estrato único, alianado, con una altura que varía entre 3 y 5 m y una densidad (100 %) que no permite el paso de la luz; por ello, es muy pobre en especies (Tab. 19). Además dificulta extraordinariamente el andar. Se eligió como typus el equivalente en este trabajo a Tabla 19, inv. 4. Forma parte del conjunto de ecosistemas que conforman el delta del río Sevilla. Se presenta en el borde interior de los manglares, por lo que el suelo está constituido por sedimentos cuaternarios típicos del manglar. El agua se encuentra alrededor de 10 cm por debajo del nivel del suelo y solo es influenciada por las grandes mareas.
Tabla 19. Dalbergietum brownei Reyes & Acosta 2003.

Además. Inv. 2. Muntingia calabura L. (+.1); Inv. 4. Thespesia polpunea Corr. (+.1).
Tiene un solo estrato con dos subestratos, el inferior, que no sobrepasa los 10 cm de altura tiene una cobertura de más del 80 % y se compone fundamentalmente de Sesuvium portulacastrum. El superior, integrado por ciperáceas y sufrutices diversos, generalmente es menor de 60 cm de alto y tiene una baja cobertura, alrededor del 10 %. Se escogió como typus el equivalente en este trabajo al inv. 2, Tabla 20. Se presenta en la desembocadura del río Guamá, en lugares depresionales, arenosos, detrás de la duna costera.
Tabla 20. Cypero-Sesuvietum portulacastri Reyes & Acosta 2003.
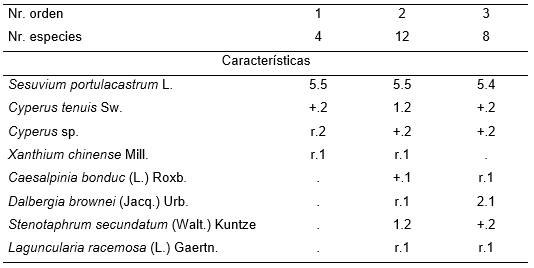
Además. Inv. 2. Ipomoea pes-caprae (L.) Roth. +.1, Chloris inflata Link.,r.2, Sporobolus virginicus (L.) Kuntz. r.2, Dichrostachys cinerea (L.) Wr. & Arn. r.1; Inv. 3. Pluchea carolinensis (Jacq.) D. Don +.1.
Debido a un desarrollo histórico y paleogeográfico particular, la región oriental de Cuba presenta características florísticas y fitosociológicas diferentes al resto del país, incluyendo los humedales. Sin embargo, los sintáxones natantes estudiados son relativamente uniformes en su composición florística y constituyen la misma asociación descrita en la parte occidental del archipiélago cubano [28], aunque diferentes de las observadas en los humedales del Departamento del Cesar (Colombia) [29].
La mayoría de los estudios fitosociológicos en los humedales y zonas costeras fueron realizados en la parte occidental del país ([23], [24]); por ello, los sintáxones costeros tienen una posición cenótica en que gran parte de las alianzas y la mayoría de las asociaciones no fueron descritas anteriormente.
Menéndez et al. [11] describen una alternancia de manglares en que las comunidades, aunque ellos no lo enuncian como tal, son disímiles a las de la zona Suroriental de Cuba. Tiene a su vez una gran importancia en la diferenciación de los sintáxones en los manglares el gradiente que provoca la dispar influencia de la marea y del agua dulce [11]. Los manglares más altos se presentan en las áreas más cercanas al mar o a los esteros, mientras que los manglares achaparrados se encuentran detrás, con menor efecto de la marea, llegando incluso, en los lugares donde dicho influjo es ocasional a producirse saladares, con sintáxones más ricos en Batis maritima y donde Avicennia germinans no sobrepasa los tres metros. Las comunidades asociadas al manglar se presentan en los bordes interiores del mismo ([5], [25]), con mayor incidencia del agua dulce, aunque constituyendo parte integrante del mismo y no un ecotono propiamente dicho.
Respecto a los manglares Cuatrecasas [30] nombró el orden Rhizophoretalia como sintaxon general sin designar la alianza tipo (Artículo 2b), también denominó la alianza Rhizophorion sin escoger una asociación tipo; además, nombró las asociaciones Avicennietum nitidae, Avicennietum marinae y Conocarpetum, sin denominar un sintaxon superior con ese nombre y sin elegir tipo alguno, lo que como se conoce no es reconocido por el Código Internacional de Nomenclatura Fitosociológica [17]. Borhidi [24] utilizó las alianzas Rhizophorion occidentalis Cuatrecasas 1958 y Avicennión occidentalis Cuatrecasas 1958, así como el orden Avicennietalia Cuatrecasas 1958, sin una diagnosis original suficiente ni una referencia inequívoca de un sintaxon efectivamente publicado (Artículo 2b), lo que los invalida; tampoco escogió la asociación correspondiente al tipo con igual consecuencia (Artículos 5, 8) [las especies Rhizophora occidentalis y Avicennia occidentalis no se encuentran publicadas ([11], [31], [32], entre otros) y en ninguna de las bases de datos (J. Orlando Rangel-Ch., com. pers.)]. Dicho autor [24] también empleó el orden Combretalia Cuatrecasas 1958 igualmente sin una diagnosis o referencia anteriormente expuesta (Artículo 2b, 5, 8); además denominó la alianza Conocarpo - Laguncularión (Cuatrecasas 1958) Borhidi in Borhidi et al. 1979 sin designar asociación tipo, lo que igualmente las anula.
Por ello, en concordancia con el Código expuesto, se reconoce en [7] al orden Rhizophoretalia Cuatrecasas ex Reyes 2014 (Artículo 46D) y se designa como alianza tipo a Rhizophorion Cuatrecasas ex Reyes 2014 (46D), la que a su vez se valida con la asociación Rhizophoretum manglis Cuatrecasas 1958 in Reyes (46D) [7], publicada legítimamente con una diagnosis original suficiente [5]. Respecto al orden Avicennietalia se considera como typus la alianza Avicennion germinantis Reyes 2014 [7] y se designa como su typus la asociación Avicennietum germinantis Reyes & Acosta 2003, la que fue efectivamente publicada [5]. Al validar el nombre, el orden se denominaría Avicennietalia Borhidi ex Reyes 2014 (Artículo 46D). Con relación a Combretalia, se considera como holotipo la alianza Batidi maritimae-Conocarpodion erecti Reyes 2007 y se designa como su holotipo la asociación Lycio caroliniani-Conocarpodetum erecti Reyes 2007 (corrigiéndose ortográficamente, Artículo 41b), ambas fueron efectivamente publicadas [25]. Al validar el nombre [7], el orden se denomina (Artículo 46D) Combretalia Borhidi ex Reyes 2014.
Respecto a la clase se acepta la expuesta por Borhidi [33] Rhizophoro-Avicennietea germinantis Borhidi & Del Risco in Borhidi 1991 ya que tiene prioridad sobre Rhizophoretea mangle Bolòs, Cervi & Hatschbach 1991, pues el primer nombre había sido publicado válidamente con anterioridad ([28],[34]), teniendo por tanto un claro criterio de prioridad (Definición VI, Principio IV, Artículos 22 y 23) según el Cógigo anteriormente expuesto [17].
En estos humedales se incluyen cinco formaciones vegetales. En general se encontraron cuatro clases, seis órdenes, ocho alianzas y 20 asociaciones; de ellas una, una, dos y nueve respectivamente son nuevas descripciones. Todas las seis subasociaciones y cinco variantes no estaban referidas; ello indica la gran diversidad sintaxonómica de estos humedales.
Se aclara la posición sintaxonómica de los manglares. Los manglares de San Miguel de Paradas y sus comunidades asociadas constituyen el ecosistema más variado.
[1] Gayot M., Laval S. & Genesseaux G. (2007). Inventaire des zones humides de la Martinque. Rapport de Synthese. Parc Natural Régionel de la Martinique. ACER campestre. 104 p.
[2] Delgado F., Ferro J. & Hernández D. (2004). Vegetación de los humedales de la reserva de la biosfera Guanacahabibes, Cuba. En: J.J. Neiff (Eds.) Humedales de Iberoamérica, 12-20 p. CYTED.
[3] Menéndez L. & Guzmán J.M. (2007). Estado de los ecosistemas terrestres en los cayos. En: Ecosistema Sabana Camaguey: Estado Actual, avances y desafíos en la protección y uso sostenible de la biodiversidad, 56-61 p. Proyecto PNUD-GEF. La Habana.
[4] Fernández L., Labrada M., Barranco G., Cárdenas O., Roque A., Alfonso H., Marrero L. & Azor L. (2011). Resultados preliminares de la evaluación ambiental integral de los principales humedales de Cuba. Caso Ciénaga de Zapata. En: A. Vanina, L. Fernández y J. Buitargo (Eds.) Experiencias de la aplicación del enfoque GEO en la evaluación de ecosistemas degradados de Iberoamérica. 37-61 p. CYTED.
[5] Reyes, O.J. & Acosta Cantillo F. (2003). Fitocenosis presentes en las áreas costeras del Sur de la Sierra Maestra. I. Comunidades con influencia marina. Foresta Veracruzana 5(2): 1-8.
[6] Galán de Mera A. & Vicente Orellana J.A. (2006). Aproximación al esquema sintaxonómico de la vegetación de la región del Caribe y América del Sur. Anales de Biología 28: 3-27.
[7] Reyes O.J. (2014). Delta del río Cauto, Segundo Humedal del Caribe Insular, Cuba. Vegetación y Sintáxones. Editorial Académica Española. Saarbrücken, Germ. 147 p.
[8] Cortés-Castillo D.V. (2016). Vegetación estuarina y vegetación acuática de los complejos cenagosos del Caribe Colombiano. Tesis Dr. Ciencias Biológicas. Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá. 255 p.
[9] Alcolado P.M. & Menéndez L. (2006). Mortalidad masiva de manglares: un caso en el norte de Cuba. En: L. Menéndez & J.M. Guzmán (Eds.) Ecosistema de manglar en el Archipiélago cubano, Estudios y experiencias enfocados a su gestión. 295-299 p. Editorial Academia, La Habana.
[10] Martínez-Montero R. & Quirós A. (2007). Avances y metas para la protección de la biodiversidad del Sistema de Áreas Protegidas del Ecosistema Sabana-Camagüey. En: Ecosistema Sabana Camaguey: Estado Actual, avances y desafíos en la protección y uso sostenible de la biodiversidad. 105-110 p. Proyecto PNUD-GEF. La Habana.
[11] Menéndez, L., Guzmán J.M. & Priego A. (2006). Manglares del archipiélago cubano: aspectos generales. En: L. Menéndez & J.M. Guzmán (Eds.) Ecosistema de manglar en el Archipiélago Cubano, Estudios y experiencias enfocados a su gestión. 17-27 p. Editorial Academia, La Habana.
[12] Colectivo de Autores. (2011). Bosques de Cuba. Editorial Científico-Técnica (Eds.). La Habana.
[13] Guevara, V., Y. Rodriguez & A. Roque (Redactores Temáticos). (2019). Precipitación media hiperanual 1961-2000. En: Atlas Nacional de Cuba LX Aniversario. La Habana.
[14] Pérez, C.M., Chuy T. & Geler T. (Redactores Temáticos). (2019). Geología. En: Atlas Nacional de Cuba LX Aniversario. La Habana.
[15] Braun Blanquet, J. (1951). Pflanzensoziologie; Grunzüge der Vegetationskunde. 2 Aufl. Wien.
[16] Scamoni A. & Passarge H. (1959). Gedanken zu einer natürlichen Ordnung der Waldgesellschaften. Arch. Forstw. 8: 382-426.
[17] Theurillat, J.P., Willner, W., Fernández-González, F., Bültmann, H., Čarni, A., Gigante, D., Mucina, L. & Weber, H. (2020). International Code of Phytosociological Nomenclature. 4th edition. Appl. Veg. Sci. https://doi.org/10.1111/avsc.12491.
[18] Acevedo-Rodriguez P. & Strong M.T. (2012). Catalogue of Seed Plants of the West Indies. Smithsonian Contributions to Botany 98. 1192 p. Disponible en: http://repository.si.edu/xmlui/handle/10088/17551.
[19] Greuter W. & Rankin Rodríguez R. (2016). The Spermatophyta of Cuba. A Preliminary Checklist. Part II: Checklist. Botanischer Garten - Botanisches Museum Berlin-Dahlem & Jardín Botánico Nacional, Universidad de La Habana. 398 p. Disponible en: https://www.researchgate.net/publication/301326599. (Consulta: Junio 2019).
[20] Greuter W. & Rankin Rodríguez R. (2017). Vascular plants of Cuba. A preliminary checklist. Second, updated Edition of The Spermatophyte of Cuba, with Pteridophyte added. Botanischer Garten - Botanisches Museum Berlin-Dahlem & Jardín Botánico Nacional, Universidad de la Habana. 444 p. Disponible en: https://www.bgbm.org/sites/default/files/plantas_vasculares_de_cuba_2017-12-18.pdf. (Consulta: Junio 2021).
[21] Sánchez C. (2017). Lista de los helechos y licófitos de Cuba. Brittonia, DOI 10.1007/s12228-017-9485-1. ISSN: 0007-196X (print) ISSN: 1938-436X. 23 June 2017.
[22] Borhidi A., Fernández-Zequeira M. & Oviedo Prieto R. (2017). Rubiáceas de Cuba. Akademiai Kiadó. Budapest. Disponible en: https://go.gale.com/ps/anonymous?id=GALE%7CA581941449&sid=googleScholar&v=2.1&it=r&linkaccess=abs&issn=02366495&p=AONE&sw=w. (Consulta: Mayo 2020).
[23] Samek V. (1973). Vegetación litoral de la costa norte de la provincia de la Habana. Academia Ciencias Cuba, La Habana. Serie Forestal 18. 86 p.
[24] Borhidi A. (1996). Phytogeography and Vegetation Ecology of Cuba. 2 Ed. Akadémiai Kiadó. Budapest. 926 p.
[25] Reyes, O.J. & Acosta Cantillo F. (2007). Principales fitocenosis en el humedal del delta del río Cauto, Cuba Oriental. II. Herbazal halófito y Manglares. Foresta Veracruzana 9(2): 1-8.
[26] Delgadillo J., Peinado M., Martinez J.M., Alcaraz F. & De La Torre A. (1992). Análisis fitosociológico de los saladares y manglares de Baja California, México. Acta Botánica Mexicana 19: 1-35.
[27] Peinado M., Alcaraz F., Delgadillo J., De La Cruz M., Álvarez J. & Aguirre J.L. (1994). The coastal marshes of California and Baja California. Phytosociological typology and zonation. Vegetatio 110(1): 55-66.
[28] Borhidi, A., Muñiz, O. & Del Risco, E. (1983). Plant communities of Cuba. I. Fresh- and salt water, swamp and coastal vegetation. Acta Bot. Hung. 29: 337 - 376.
[29] Rangel-Ch, O.J. (Ed.). (2012). Las Ciénagas del Departamento del Cesar: Zapatosa y Ciénagas del Sur. Biodiversidad y conservación. En: Colombia Diversidad Biótica. Publicación especial Nr. 7. Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
[30] Cuatrecasas J. (1958). Introducción al estudio de los manglares. Boletín de la Sociedad Botánica de México 23: 84-98.
[31] Barrios A.E. & De León L.M. (1994). Los manglares de Guatemala. En: D.O. Suman (Ed.). El ecosistema de manglar en América Latina y la cuenca del Caribe: su manejo y conservación. p. 125-132. Rosentiel School & Marine and Atmospheric Science. The Tinker Foundation.
[32] Oviedo Prieto, R., Menéndez, L. & Guzmán, J.M. (2006). Flora asociada a manglares y sus ecotonos. En: L. Menéndez & J.M. Guzmán (Eds.) Ecosistema de manglar en el Archipiélago Cubano, Estudios y experiencias enfocados a su gestión. 44-57 p. Editorial Academia, La Habana.
[33] Borhidi, A. (1991). Phytogeography and Vegetation Ecology of Cuba. Akadémiai Kiadó. Budapest. 858 p.
[34] Borhidi, A., Muñiz, O. & Del Risco, E. (1979). Clasificación fitocenológica de la vegetación de Cuba. Acta Bot. Acad. Sci. Hung. 25: 263-301.