ALEACIONES METÁLICAS PARA APLICACIONES ORTOPÉDICAS: UNA REVISIÓN SOBRE SU RESPUESTA AL ESTRÉS FISIOLÓGICO Y A LOS PROCESOS DE CORROSIÓN
Katherine Ríos-Puerta 1, Omar Darío Gutiérrez-Flores 2
1Estudiante Ingeniería Biomédica, Facultad Ciencias Exactas y Aplicadas, Instituto Tecnológico Metropolitano, Calle 73 No 76A-354 Vía al Volador, Medellín, Colombia, katherinerios180744@correo.itm.edu.co.
2Grupo de Química Básica, Aplicada y Ambiente, Facultad Ciencias Exactas y Aplicadas, Instituto Tecnológico Metropolitano, Calle 73 No 76A-354 Vía al Volador, Medellín 050034, Colombia, omargutierrez@itm.edu.co.
RESUMEN
El campo de los biomateriales y sus aplicaciones contribuyen significativamente a la salud y calidad de vida de las personas. Aunque existen varios grupos de biomateriales como cerámicos, polímeros, metales y todos en un determinado porcentaje se utilizan para diferentes procedimientos con objetivos específicos, este artículo de revisión se centra en los metales y sus aleaciones, la resistencia de estos a la corrosión en un entorno biológico y la protección contra el estrés fisiológico. Para esta revisión se seleccionaron artículos que permiten describir dichos aspectos de las aleaciones metálicas utilizadas en aplicaciones ortopédicas partiendo de una detallada búsqueda electrónica, a partir de ello, se concluye que la resistencia a la corrosión y el estrés fisiológico son dos aspectos tan neurálgicos que muchas de las investigaciones realizadas tienen como objetivo mejorarlos garantizando el éxito de la osteosíntesis y la recuperación satisfactoria del paciente.
Palabras clave:aleaciones metálicas, biocompatible, corrosión, ortopedia
Recibido: 18 de agosto de 2021. Aceptado: 02 de marzo de 2022
Received: August 18, 2021. Accepted: March 02, 2022
METALLIC ALLOYS FOR ORTHOPEDIC APPLICATIONS: A REVIEW OF THEIR RESPONSE TO PHYSIOLOGICAL STRESS AND CORROSION PROCESSES
ABSTRACT
The field of biomaterials and their applications contribute significantly to the health and quality of life of people. Although there are several groups of biomaterials such as ceramics, polymers, metals and all of them in a certain percentage are used for different procedures with specific objectives, this review article focuses on metals and their alloys, their resistance to corrosion in a biological environment and protection against physiological stress. For this review, articles were selected to describe these aspects of metal alloys used in orthopedic applications based on a detailed electronic search. From this, it is concluded that resistance to corrosion and physiological stress are two aspects so crucial that many of the researches carried out aim to improve them to ensure the success of osteosynthesis and the satisfactory recovery of the patient.
Keywords: metal alloys, biocompatible, corrosion, orthopedics
Como citar este artículo: Ríos-Puerta, K. & Gutiérrez-Flores, O. D. (2022). Aleaciones metálicas para aplicaciones ortopédicas: una revisión sobre su respuesta al estrés fisiológico y a los procesos de corrosión. Revista Politécnica, 18(35), 24-39. https://doi.org/10.33571/rpolitec.v18n35a2
INTRODUCCIÓN
En 2018 el termino biomaterial fue definido como “un material diseñado para tomar una forma que pueda dirigir, a través de las interacciones con los sistemas vivos, el curso de cualquier procedimiento terapéutico o de diagnóstico” [1].Los diferentes biomateriales y sus múltiples aplicaciones contribuyen enormemente a la calidad de vida de los pacientes, encontrar o crear un material que cumpla con las necesidades de cada cuerpo es fundamental, por esto , el estudio de estos materiales es fuertemente motivada.
Los reemplazos articulares, válvulas cardiacas, placas óseas, stents son algunas de las aplicaciones en las que se utilizan los materiales, por muchos años han existido 3 grupos fundamentales de materiales, metales y aleaciones, cerámicos y polímeros [2].
Los biomateriales para el área ortopédica deben poseer buena biocompatibilidad, resistencia a la corrosión, no ser tóxicos y que sus propiedades mecánicas sean las adecuadas [3].
Los metales y sus aleaciones han cogido mucha fuerza en el campo medico por sus excelentes propiedades, permitiendo que los implantes ortopédicos, por ejemplo, tengan una longevidad más duradera evitando que el paciente sea sometido a cirugías de revisión o retiro del material [4].
Existen dos aspectos fundamentales que se evalúan para que un implante sea exitoso en un huésped, el primer aspecto es la resistencia a la corrosión, todos los metales y sus aleaciones sufren de un proceso oxidativo cuando entran en contacto con fluidos corporales, al ocurrir este proceso se liberan iones metálicos causantes de generar procesos inflamatorios y reacciones alérgicas que producen la destrucción de los tejidos, provocando el aflojamiento del dispositivo [5].Por otra parte está el estrés fisiológico, que es provocado por el desajuste del módulo de elasticidad entre el hueso y el implante [6], [7]; la cantidad de tensión que soporta el hueso o el dispositivo está directamente relacionado con que tan rígido es cada uno, si el implante es más rígido que el hueso , este genera una protección contra el estrés , produciendo que el hueso se vuelva menos denso , debilitando su estructura gravemente y en el momento de retirar los implantes se generarían refracturas porque no se creó un hueso de calidad [8] [9].
2. ¿QUÉ ES UN BIOMATERIAL?
El termino biomaterial fue definido en 1986 como “un material no viable utilizado en un dispositivo médico, destinado a interactuar con sistemas biológicos”, en ese momento de la historia los biomateriales se usaban para tratar, aumentar o remplazar tejidos, órganos o tejidos del cuerpo si generar reacciones adversas. Después de muchos años nació la necesidad de redefinir el termino porque la descripción “no viable” ya no era relevante y se logró una nueva definición en el 2018 y es: “un material diseñado para tomar una forma que pueda dirigir, a través de las interacciones con los sistemas vivos, el curso de cualquier procedimiento terapéutico o de diagnóstico” [1].
Los materiales artificiales o naturales que se utilizan para reemplazar o complementar los tejidos biológicos y sus funciones ayudan a mejorar la calidad de vida, la longevidad de los seres humanos y la experiencia frente a los tratamientos, por esto, el campo de los biomateriales crece cada vez más para satisfacer la demanda de la sociedad [10],[11].
Estos materiales son utilizados en diferentes partes del cuerpo como válvulas artificiales, implantes de reemplazo de diferentes articulaciones y estructuras dentales. estos elementos como el aluminio, cromo o níquel liberan iones debido a la corrosión o estrés fisiológico generando inflamación y reacción alérgica que causan la destrucción de los tejidos y el aflojamiento del componente, dejando como consecuencia cirugías del revisión o reemplazo [2], [12].
Con el transcurrir del tiempo han surgido nuevas tecnologías como la ingeniería de tejidos, terapias celulares, impresión de órganos y sistemas de diagnóstico [13],[14], la demanda en aumento de implantes hace indispensable el desarrollo de nuevos biomateriales y estos deben poseer buena biocompatibilidad, resistencia a la carga, a la corrosión y resistencia a la fatiga y no ser toxico [6] [15] [16].
En estos procesos se utilizan metales, cerámicos, polímeros, biopolímeros, auto sistemas y nanopartículas entre otros, por esto nuestros conceptos originales de biomateriales y las expectativas de su desempeño tienden a cambiar [17] y se llega a la conclusión de que muchas sustancias antes no utilizadas ni pensadas como biomateriales potenciales ahora deben ser considerados como tal junto a los materiales convencionales [18].
Existen múltiples causas para que un implante falle y esto deje como consecuencia cirugías de revisión, aumentando la probabilidad de infecciones por segundas intervenciones. En la Fig.1. se presentan las diferentes causas por las que fallas los implantes.
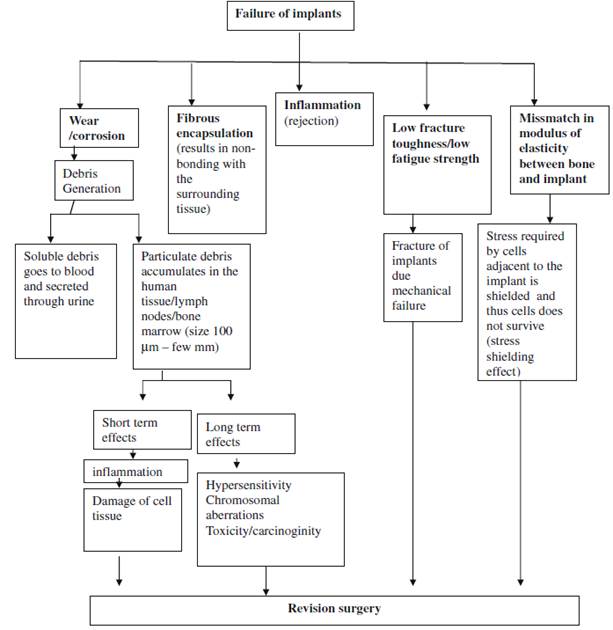
Fig.1. en esta imagen podemos evidenciar que existen múltiples causas por las que los implantes pueden fallar, en esta lista se encuentran los procesos de corrosión y el estrés fisiológico, lo que causaría cirugías de revisión[19].
3. REQUISITOS DE UN BIOMATERIAL
Todas las aplicaciones biomédicas contribuyen significativamente en la salud y calidad de vida de las personas, por esto la investigación exhaustiva de los materiales es fuertemente motivada, estas aplicaciones relacionan tres grandes grupos de materiales ya que rara vez alguno de estos se usa completamente solo, en la mayoría de los casos se fabrican híbridos, por ejemplo, las endoprótesis de cadera. En la Fig.2. se ilustra esta endoprótesis a partir de una aleación de acero inoxidable o titanio (vástago), una cerámica (cabeza) y un polímero (inserto)[20],[21].
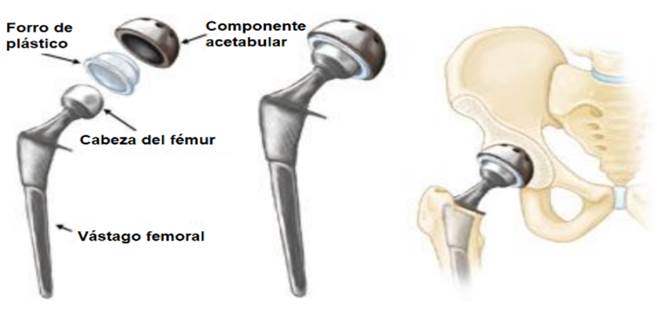
Fig.2.endoprotesis de cadera que consta de cuatro componentes para imitar la función natural de la articulación [22].
Existen dos aspectos fundamentales tenidos en cuenta al momento de escoger un material para una aplicación ortopédica:
Resistencia a la corrosión
Todos los metales y aleaciones sufren de corrosión cuando entran en contacto con fluidos corporales, ya que este entorno tiende a ser agresivo por la presencia de proteínas y iones de cloruro. Al ocurrir el proceso oxidativo se liberan iones metálicos causantes de generar procesos inflamatorios y reacciones alérgicas que producen la destrucción de los tejidos, provocando el aflojamiento del dispositivo, ya sabemos que este aflojamiento requiere de segundas intervenciones para cambio o revisión del material [5].
Estrés fisiológico
El estrés fisiológico es provocado por el desajuste en el módulo de elasticidad entre el hueso y los implantes, como consecuencia se presentaría la reabsorción del hueso circundante por una transferencia de carga insuficiente [6], [7].
La reducción prolongada de la tensión puede ocasionar que el hueso se debilite, en el reparto de la carga entre el hueso y el implante, la cantidad de tensión que soporta cada uno está relacionado con que tan rígido es [23], al ser el implante más rígido que el hueso este genera una “protección contra el estrés“ [8] [9] , esta protección afecta la remodelación y cicatrización ósea haciendo que el hueso se vuelva poroso y débil [24],[25]. Como el hueso debajo de los implantes se adaptó a esa baja tensión, el hueso curado va a ser débil y por eso al retirar los implantes se pueden presentar refracturas, esto pasa más con el acero que con el titanio, ya que el titanio posee la biocompatibilidad y el comportamiento biomecánico adecuado, además, la alta resistencia a la fatiga y a la tracción y su bajo módulo elástico, lo convierten en un material menos propenso a generar esta protección [23][9][26].
Un implante debe tener las siguientes propiedades:
Propiedades mecánicas:
Algunas de las propiedades más importantes son la dureza y la resistencia a la fatiga, esta última es factor determinante en el éxito del implante ya que es la respuesta del material a las cargas y a la deformación [3] . Hay muchos materiales actuales que tiene mayor rigidez que el hueso, evitando que la tensión se transfiera al hueso adyacente, provocando la reabsorción ósea alrededor del implante y, en consecuencia, el aflojamiento del material causando múltiples complicaciones [27].
Biocompatibilidad:
El factor más importante que diferencia un biomaterial de otro material es la capacidad de coexistir con los tejidos del cuerpo humano sin causar un daño exagerado en el huésped. Lo que se busca es que los materiales sean atóxicos, no causen inflamación ni alergia al cuerpo, la reacción del huésped al implante y la degradación del material en el cuerpo son los factores que influyen en la biocompatibilidad [28].
La calidad de la intervención clínica que pone en contacto el material con el tejido es de suma importancia, también son importantes las características del individuo donde se coloca el implante y gran parte del éxito se centra allí, juegan un papel importante el sexo, la edad, enfermedades de base, la actividad física del paciente, por esto, el diseño del dispositivo y su relación física con el cuerpo son determinantes para que exista una biocompatibilidad optima[29].
La presencia de microorganismos y endotoxinas son factores determinantes en la biocompatibilidad; las endotoxinas son una parte de la membrana celular de las bacterias Gram-negativas [30], cuando estas ingresan al torrente sanguíneo producen en el cuerpo fiebre, escalofríos, hipotensión y dificultad para respirar, por otra parte, estimula los procesos inflamatorios, haciendo más difícil la curación y cicatrización[31].
Para solucionar eficazmente esta problemáticamente cada vez más se está estudiando los recubrimientos con elementos bactericidas, aumentando la biocompatibilidad del implante y disminuyendo los efectos adversos en el cuerpo[32],[33].
Resistencia a la corrosión y al desgaste
la corrosión y la baja resistencia al desgaste del implante provoca la liberación de iones en el cuerpo humano causantes de respuestas inflamatorias y alergias [34] ,el desarrollo de implantes con una buena resistencia a la corrosión condicionase la vida útil del material en el cuerpo [35].
Osteointegración
Los materiales con una superficie adecuada son indispensables para que el implante se integre bien con el hueso adyacente, si no ocurre una buena integración se crea un tejido fibroso entre los dos y se presenta el aflojamiento del componente [36].
En el proceso de osteointegración se presenta la producción y remodelación del tejido óseo en la superficie del dispositivo implantado, creando una cercanía entre implante y hueso, pero sin que se produzca tejido fibroso o colágeno[37]. Albrektsson [38] describe como se han insertado implantes de titanio sin cementar, buscando que el contacto entre el implante y el hueso fuera mayor, con microscopía electrónica se evidenció que no había desgaste de hueso y tejido blando; un resultado muy importante que mostró este estudio fue la adherencia del tejido al titanio, consiguiendo una protección biológica y a su vez disminuyendo la posibilidad de entrada de microorganismos, beneficiando la biocompatibilidad.
4. METODOLOGÍAS DE SÍNTESIS
En el campo medico se han utilizado recientemente técnicas de fabricación aditiva que permiten crear dispositivos a partir de prototipos de diseño asistido para la obtención de implantes metálicos, las técnicas convencionales producen implantes en serie, lo que impide que sean adaptados a las necesidades de cada paciente y no hay la posibilidad de hacerlos porosos para activar la osteointegración[39]. Para la fabricación de los diferentes tipos de implantes existen diversas metodologías de síntesis, esto tiene un efecto directo en las propiedades del material [40].La Fig.3. muestra las diferentes aplicaciones médicas en las que se utilizan estas técnicas, entre esas están prótesis, instrumentos quirúrgicos, implantes[41].
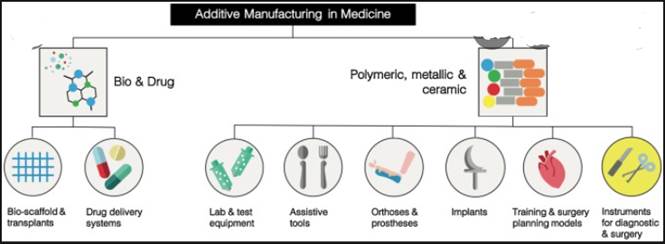
Fig.3. Aplicaciones de la fabricación aditiva en diversos campos médicos[41].
En la fusión en lecho de polvo se funde un material en polvo a altas temperaturas, este método se utiliza para crear piezas funcionales ya que las piezas obtenidas tienen unas propiedades mecánicas adecuadas, tienen alta durabilidad y ayudan a reducir el estrés excesivo ya que pueden crearse dispositivos porosos con un módulo de Young similar al del hueso natural facilitando el crecimiento óseo[42]. Este método se presenta como uno de los más indicados para fabricar implantes metálicos, por su bajo costo y porque permite crear implantes personalizados [43].Pero, presenta algunas falencias como el atrapamiento de polvo causando fallas en las piezas, para dar solución a esto, algunos estudios describen métodos para la eliminación como utilizar temperatura, vibración, aire o gas y estudian el efecto en las propiedades después de esto[44]. Por ejemplo, se realizó un estudio donde sumergían las piezas en nitrógeno y luego eran expuestas a vibraciones ultrasónicas, mostrando el retiro exitoso del polvo y no evidenciando el cambiado de las propiedades significativamente[45].
La deposición de energía dirigida emplea una fuente de energía directa, para fundir el material que se encuentra como polvo metálico o alambre y luego se deposita en una bandeja para construir el implante. Aunque es un método llamativo por su rapidez, el producto final no presenta las propiedades mecánicas que se esperan para que estén en el cuerpo humano [46].
el método de chorro de aglutinante consiste en inyectar un líquido aglutinante por una o más boquillas para pegar el polvo y formar la figura, el éxito del producto final depende del grosor del gano, afectando las propiedades mecánicas, la resistencia a la tensión [47],[46].
en el proceso de laminación de hojas se utilizan láminas de metal como materia prima, se usa generalmente el láser para unir las láminas que están cortadas con precisión para formar el implante deseado, es mucho más económico crear implantes con láminas de metal que con polvo [48],[49].
La Fig.4.Ilustra varias aplicaciones biomédicas
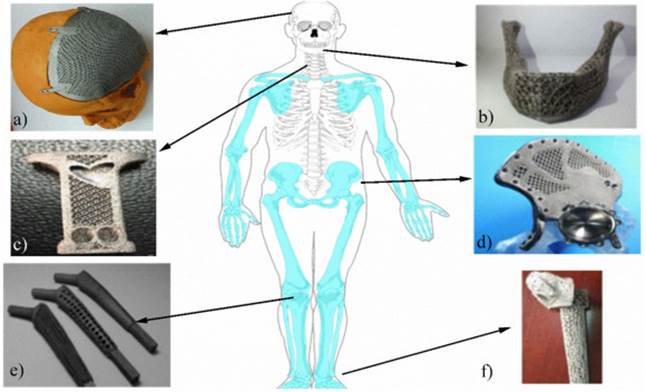
Fig.4.Ejemplo de implantes metálicos. a) placa craneal, b) prótesis mandibular, c) caja de fusión vertebral, d) implante pélvico, e) vástagos para endoprótesis, f) implante de tobillo [50]–[52][53].
5. APLICACIONES BIOMÉDICAS Y SUS LIMITACIONES DEBIDAS AL ESTRÉS FISIOLÓGICO Y A LOS PROCESOS DE CORROSIÓN
Como se mencionó anteriormente hay varios grupos de materiales, estos son utilizados en determinadas aplicaciones según sus propiedades, algunos materiales para implantes son:
Metales y sus aleaciones: en este grupo se encuentra el acero inoxidable, el titanio y aleaciones (Ti – Cr, Ti – Mo, Ti – Zr – Cr, Ti – Zr – Mo), Aleaciones a base de Co (Co – Cr) y de Ta, Nb, Zr, Mg, Fe, son utilizados principalmente para reconstruir tejido duro, como reemplazos articulares, material para fijación ósea como tornillos, placas, alambres. Poseen alta resistencia, excelente resistencia a la corrosión, buena biocompatibilidad y modulo bajo (más el titanio que el acero), lo que disminuye la protección contra estrés evitando la reabsorción ósea, pero tiene desventajas como la baja resistencia al desgaste en condiciones de carga o fatiga, aunque tiene buena biocompatibilidad estudios recomiendan mejoras significativas[19][54][55][56].
Cerámicos: acá se presentan Biocerámicas a base de Na 2O-CaF2-P 2O 5 -SiO 2 y cerámicas absorbibles como Ca 10 (PO 4 ) 6 (OH) 2 y Ca 3 (PO 4 ) 2 [57], es muy utilizado para reemplazo de componente acetabulares, rellenos óseos, tratamiento de ligamentos y tendones y para osteosíntesis, al igual que los metales este grupo posee buena resistencia a la corrosión , excelente biocompatibilidad y resistencia a la fractura pero este grupo tiene baja durabilidad debido a las cargas mecánicas [58][59], [60].
Polímeros y sus compuestos: entre ellos están el polietileno, polipropileno, poliuretano, son usados comúnmente en implantes compuestos como las endoprótesis, es flexible, biocompatible, resistencia a efectos bioquímicos, mayor resistencia a la fatiga, pero presenta baja resistencia a la deformación y menor carga de rotura[56], [61], [62].
Existen múltiples aplicaciones biomédicas y todas en pro del bienestar del ser humano, estas han aumentado la demanda de biomateriales en general, pero se ha presentado un gran auge en los metálicos. Los materiales más utilizados incluyen acero inoxidable 316L (316LSS), aleaciones de cromo cobalto (Co-Cr) y titanio y sus aleaciones [63].
Para satisfacer las necesidades del campo médico, se espera que los materiales biomédicos ideales tengan buena biocompatibilidad, propiedades mecánicas adecuadas y buena resistencia a la corrosión [64],[65]. De las aplicaciones médicas como stents intravasculares, lentes intraoculares, dispositivos para el manejo del ritmo cardiaco, reconstrucción de tejidos blandos, Algunas aplicaciones ortopédicas son:
Prótesis para reemplazos articulares
Estos reemplazos se han vuelto más comunes desde hace unos años, por la importancia de esta aplicación y lo que significa reemplazar completamente la articulación [66], se deben evaluar meticulosamente las propiedades de los materiales a utilizar para minimizar el deterioro del material y facilitar la incorporación a largo plazo del dispositivo en el sistema muscoesqueletico[67], por esto, estudios muestran que las aleaciones de titanio se adhieren mejor y más rápido al hueso mostrando un equilibrio entre las propiedades mecánicas[68] [69].los reemplazos articulares son procesos irreversibles por la cantidad de cartílago y hueso extraído para el procedimiento , por esto la selección del material es crítico y determinante para el éxito de la intervención[10].
Placas óseas para reparación de fracturas
Estas son utilizadas ampliamente para tratar las fracturas (reducción anatómica) [70] y así restaurar las funciones del tejido óseo, ayudando en la curación y permitiendo que el paciente recupere el movimiento y la función de la extremidad o parte del cuerpo a tratar [3]. En esta aplicación los fragmentos óseos se mantienen unidos por diferentes componentes como platinas, alambres, tornillos, o clavos, los materiales más utilizados son metales como acero inoxidable, aleaciones de Co-Cr o Ti [71].
Instrumentación de columna
La columna vertebral debe ser un eje central fuerte para dar soporte a todo el cuerpo y a la vez ser flexible en pro del movimiento, a su vez debe brindar la protección a la medula espinal [72]. A lo largo de los años se han identificado varias patologías relacionadas a la columna como hernias, escoliosis y degeneración, para darle solución a esta problemática se utilizan reemplazos de discos, injertos óseos o inmovilización quirúrgica de la articulación entre dos vertebras [73].
Como ya se ha evidenciado en este artículo, los metales y sus aleaciones son los más opcionados para las aplicaciones ortopédicas, por generar una mayor confianza para tratamientos a largo plazo por la resistencia mecánica que poseen, asegurando una mayor longevidad del implante en el huésped, aunque tienen muy buenas características no se debe olvidar que hay aspectos a mejorar para que sea un material más seguro y así contrarrestar sus falencias.
Aunque en la línea de los metales hay muchos como ya los mencionamos ,el titanio y sus aleaciones se caracterizan por ser adecuados para la fabricación de implantes de carga, debido a su resistencia , biocompatibilidad y estabilidad química[74], sin embargo la constante abrasión del implante y la entrada de iones metálicos pueden provocar una reacción toxica y reabsorción ósea por lo que es fundamental modificar las superficies del dispositivo[75],cada vez más se estudia la manera de modificar el titanio para que tenga un módulo de Young más bajo y así obligar al hueso a seguir teniendo la misma densidad ósea y luchar contra el estrés fisiológico , pero hacer estas modificaciones podría ocasionar fallas tempranas[76].
A pesar de la resistencia a la corrosión y al desarrollo de biopelículas protectoras por parte del implante, el problema con estos materiales es la liberación de iones metálicos a causa de la corrosión del metal, provocando que se active el sistema inmunológico y que el paciente rechace el cuerpo extraño[77], [78].
La alta fragilidad de los cerámicos y su alto módulo de elasticidad limitan el uso de estos por las propiedades mecánicas insuficientes. Con los polímeros ocurre algo muy particular, a medida que se liberan los restos de desgaste del material, se activan las células inflamatorias y este proceso puede estimular los osteoclastos causando reabsorción y sin forma de evitarlo se presentaría el aflojamiento del implante[79], [80];lo que se busca principalmente a la hora de colocar un implante es que no cause toxicidad por la liberación de sustancias y que el hueso adyacente no sufra debilitamiento para que sus propiedades sigan intactas.
La Fig.5.presenta los diferentes elementos empleados en ingeniería de tejido óseo. [81].

Fig.5.Ejemplo de elementos utilizados para la reducción ósea, se pueden observar alambres, tornillos, grapas, placas y clavos [81] .
6. DESARROLLO DE ALEACIONES METÁLICAS COMPUESTAS
Como con los metales y aleaciones convencionales no se cumplen todas las exigencias médicas, tanto en sustitución de huesos y articulaciones, curación y renovación ósea, por los factores antes mencionados, se ha identificado un gran interés en profundizar en nuevas tendencias que satisfagan las necesidades primordiales de las que se han hablado anteriormente para ayudar a la cicatrización, una mejor función de los tejidos blandos y huesos y evitar segundas intervenciones para revisión o retiro [65] [12].
En la actualidad existen tendencias que apuntan a eliminar el estrés y corrosión:
Andamios
Los huesos por ser tejido conectivo y dinámico proporcionan movimiento, apoyo y protección, aunque la mayoría de los defectos óseos se curan por si mismos más o menos el 10% necesita de otros tipos de tratamientos como injertos, pero la poca disponibilidad y el riesgo de la transmisión de enfermedades a limitado este uso [82] [83]. Por esto, para reemplazar huesos deteriorados que no proporcionan la resistencia adecuada bajo una carga aplicada se han usado implantes densos de metal , sin embargo , las falla del sustituto óseo todavía ocurre debido a diferentes factores [19], por estos inconvenientes y para poder superarlos, en la actualidad la idea de usar una estructura porosa (andamios) es muy prometedora, donde el contacto mejorado entre el hueso y el implante surge de los poros donde se evidencia crecimiento óseo ayudando a su exitosa regeneración [84],[85].
En estos nuevos desarrollos el titanio y sus aleaciones siguen siendo los materiales más deseados, debido a su modulo relativamente bajo, su resistencia a la corrosión y su buena relación resistencia -peso[86]. Si desarrollan los andamios con este material, el problema de la osteointegración y la disminución de las propiedades mecánicas afectando el estrés fisiológico se solucionaría por el crecimiento óseo en las celdas del implante, este crecimiento de tejido óseo facilitaría la interacción entre huésped e implante, permitiendo que las cargas sean compartidas, fortaleciéndola densidad ósea y evitando refracturas [87].
Hay estudios que muestran la producción de andamios con poros uniformes, pero Thieme y col. Argumentaban que un andamio uniforme no podía adaptar sus comportamientos mecánicos a los del hueso y por esto fabricaron un andamio con poros graduados que se asemejara más al hueso cortical y esponjoso manteniendo la interconectividad[88].
En esta investigación usaron varios métodos para la producción de los poros como filtración a presión y fabricación de formas libres sólidas, pero, evidenciaron que con estos métodos es difícil controlar el tamaño y la interconectividad y que, si en la creación de los poros interconectados el canal que los conecta queda muy estrecho, es posible que el tejido y las células no puedan migrar hacia los poros y no se obtenga el resultado deseado [88].
Hay varios componentes que deben ser evaluados en esta nueva tendencia, la división adecuada del andamio es primordial para que pueda crearse el crecimiento óseo necesario y haya el soporte mecánico optimo; ya que las tasas de infección observadas en la implantación de dispositivos ortopédicos, como las prótesis primarias de cadera o rodilla, son del 1 al 2,5% y alcanzan el 20% tras la realización de cirugías de revisión [89], la bioactividad se convierte en un componente fundamental a evaluar para evitar mala osteointegración, inflamación, infecciones o recurrencia de enfermedades [90], por tanto se necesita en la plataforma un sistema de administración de antibióticos y así reducir los riesgos. La Fig.6. ilustra el esquema de fabricación de un andamio.
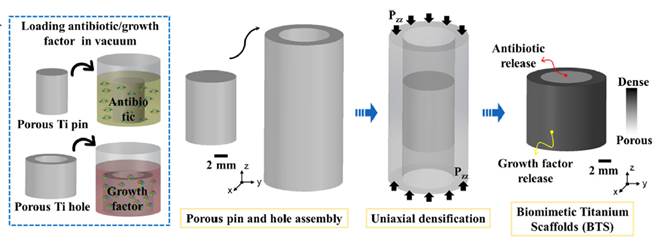
Fig.6. en este esquema del procedimiento de fabricación de un andamio de titanio se puede visualizar que se realiza una carga de antibiótico para reducir riesgo de infecciones, luego hay un proceso de ensamble de la parte más densa con la parte hueca para luego permitir la liberación del medicamento [5].
Con el crecimiento óseo en esta unidad porosa, la transferencia de tensión puede llegar a ser mucho más uniforme entre implante y hueso, ayudando significativamente al estrés [91].
Si bien los andamios por su estructura porosa favorecen a la distribución de esfuerzos mecánicos dándole una mayor resistencia a las piezas, se ha visto que en algunos casos es necesario la incorporación de nanopartículas por su inercia química y resistencia a procesos oxidativos.
Nanopartículas y metales nobles para la modificación de materiales
Como se ha hablado anteriormente los materiales utilizados tradicionalmente en ortopedia son en su mayoría metales y sus aleaciones, seguido de algunos cerámicos y polímeros. Actualmente se estudia la viabilidad de modificar las superficies de los implantes mediante películas delgadas de metales del grupo del platino y nanopartículas de plata u oro [92].Desarrollar materiales implantables que puedan funcionar en el cuerpo humano de la forma más natural posible es un reto importante [93].Los metales nobles debido a su inercia química y resistencia a la corrosión se pueden considerar materiales altamente biocompatibles [94].
Recubrimiento y nanopartículas de plata y oro
En relación con los estudios realizados sobre los metales nobles se ha encontrado que la plata tradicionalmente es utilizada como agente antibacteriano en entornos clínicos, por esta razón es un material tan llamativo para la modificación de superficies de los implantes. Este metal se puede utilizar en diversas formas como la implantación de iones en la superficie inicial(dopaje), sales de Ag, recubrimientos a base del metal [95] [96], [97] .Es un material muy llamativo pero las investigaciones han mostrado que, a pesar de ser tan biocompatible, su efecto antibacteriano no solo puede afectar las bacterias sino también las células humanas resultando muy tóxicos y poco beneficiosos [98].
No es muy claro cuál es el mecanismo de acción de la plata, hay varias hipótesis, como la liberación de iones de plata, interrupción en la producción de ATP y replicación de ADN, por esto, es tan peligroso el uso de la plata por su posible daño a las células humanas [99].
El oro ha sido utilizado en el área médica durante siglos por la alta resistencia a la corrosión en entornos biológicos y su buena biocompatibilidad [100], no tiene el mismo problema de la plata porque la acción antibacteriana del oro metálico no ha sido probada , por esto, se vuelve mucho más llamativo para los recubrimientos [101], los problemas de la acción antibacteriana se solucionaran con antibióticos y así se aprovecharía la magnífica resistencia a la corrosión del oro , garantizando una vida útil del implante más prolongada, en promedio un implante puede durar en el cuerpo de 10 a 15 años, lo que se busca con estas innovaciones es eliminar las cirugías de retiro y que el paciente pueda permanecer con el implante [102].
Algunos investigadores indican que el oro es más biocompatible que la plata por su acción bactericida casi nula, favoreciendo la buena biocompatibilidad, una excelente osteointegración y ayudando enormemente a la resistencia a la corrosión, pero no es tan utilizada por el alto costo que acarrea [103], [104].
7. CONCLUSIONES
La resistencia a la corrosión y el estrés fisiológico son aspectos neurálgicos al momento de evaluar el éxito de un implante, por esto, cada vez hay más estudios y adelantos científicos en búsqueda de estrategias para eliminar estas limitantes. Para poder mejorar la resistencia a la corrosión lo que se está implementando actualmente son los recubrimientos del implante para mejorar las características y así evitar los procesos inflamatorios y aflojamiento del implante.
Muchos materiales actuales tienen mayor rigidez que el hueso, evitando que la tensión se transfiera a este y causando una reabsorción ósea, para combatir la protección contra el estrés fisiológico se está innovando con implantes porosos para garantizar la interacción entre el hueso y el dispositivo, permitiendo que el hueso nuevo a generar sea más denso y su estructura sea la correcta.
REFERENCIAS BIBLIOGRÁFICAS
[1] L. Ghasemi-Mobarakeh, D. Kolahreez, S. Ramakrishna, and D. Williams, “Key terminology in biomaterials and biocompatibility,” Current Opinion in Biomedical Engineering, vol. 10, pp. 45–50, 2019, doi: 10.1016/j.cobme.2019.02.004.
[2] M. Saini, “Implant biomaterials: A comprehensive review,” World Journal of Clinical Cases, vol. 3, no. 1, 2015, doi: 10.12998/wjcc.v3.i1.52.
[3] J. Black and G. Hastings, “Handbook of biomaterial properties,” 2013, Accessed: Jul. 18, 2021. [Online]. Available: https://books.google.com/books?hl=es&lr=&id=EWPlBwAAQBAJ&oi=fnd&pg=PR13&ots=KmbPU9iVa6&sig=OaO6u1NxOxPuXYA2QHVTiorLvLA
[4] Q. Chen and G. A. Thouas, “Metallic implant biomaterials,” Materials Science and Engineering R: Reports, vol. 87, pp. 1–57, 2015, doi: 10.1016/j.mser.2014.10.001.
[5] “Functionally assembled metal platform as lego-like module system for enhanced mechanical tunability and biomolecules delivery - ScienceDirect.” https://www-sciencedirect-com.itm.elogim.com:2443/science/article/pii/S0264127521003932?via%3Dihub#b0030 (accessed Jul. 09, 2021).
[6] M. Long and H. J. Rack, “Titanium alloys in total joint replacement—a materials science perspective,” Biomaterials, vol. 19, no. 18, pp. 1621–1639, Sep. 1998, doi: 10.1016/S0142-9612(97)00146-4.
[7] M. Niinomi, M. N.-I. journal of biomaterials, and undefined 2011, “Titanium-based biomaterials for preventing stress shielding between implant devices and bone,” hindawi.com, Accessed: Jul. 09, 2021. [Online]. Available: https://www.hindawi.com/journals/ijbm/2011/836587/
[8] B. Moyen, P. L. Jr, … E. W.-T. J. of bone, and undefined 1978, “Effects on intact femora of dogs of the application and removal of metal plates. A metabolic and structural study comparing stiffer and more flexible plates.,” europepmc.org, Accessed: Jul. 18, 2021. [Online]. Available: https://europepmc.org/article/med/100500
[9] U. HK and F. M, “The effects of metal plates on post-traumatic remodelling and bone mass,” https://doi.org/10.1302/0301-620X.65B1.6822605, vol. 65, no. 1, pp. 66–71, Jan. 1983, doi: 10.1302/0301-620X.65B1.6822605.
[10] S. Ramakrishna, J. Mayer, E. Wintermantel, and K. W. Leong, “Biomedical applications of polymer-composite materials: a review,” Composites Science and Technology, vol. 61, no. 9, pp. 1189–1224, Jul. 2001, doi: 10.1016/S0266-3538(00)00241-4.
[11] D. W. Y. Toong et al., “Bioresorbable metals in cardiovascular stents: Material insights and progress,” Materialia, vol. 12, p. 100727, Aug. 2020, doi: 10.1016/J.MTLA.2020.100727.
[12] N. S. Manam et al., “Study of corrosion in biocompatible metals for implants: A review,” Journal of Alloys and Compounds, vol. 701. Elsevier Ltd, pp. 698–715, Apr. 15, 2017. doi: 10.1016/j.jallcom.2017.01.196.
[13] D. Wise, D. Trantolo, K. Lewandrowski, and J. Gresser, “Biomaterials engineering and devices: human applications,” 2000, Accessed: Jul. 16, 2021. [Online]. Available: https://link.springer.com/content/pdf/10.1007/978-1-59259-196-1.pdf
[14] B. Raton, L. New, Y. Washington, J. B. Park, and J. D. Bronzino, “Biomaterials : Principles and Applications,” Aug. 2002, doi: 10.1201/9781420040036.
[15] Z. Tang et al., “A materials-science perspective on tackling COVID-19,” Nature Reviews Materials 2020 5:11, vol. 5, no. 11, pp. 847–860, Oct. 2020, doi: 10.1038/s41578-020-00247-y.
[16] K. Wang, “The use of titanium for medical applications in the USA,” Materials Science and Engineering: A, vol. 213, no. 1–2, pp. 134–137, Aug. 1996, doi: 10.1016/0921-5093(96)10243-4.
[17] F. M. Chen and X. Liu, “Advancing biomaterials of human origin for tissue engineering,” Progress in Polymer Science, vol. 53, pp. 86–168, Feb. 2016, doi: 10.1016/J.PROGPOLYMSCI.2015.02.004.
[18] D. F. Williams, “On the nature of biomaterials,” Biomaterials, vol. 30, no. 30, pp. 5897–5909, 2009, doi: 10.1016/j.biomaterials.2009.07.027.
[19] M. Geetha, A. K. Singh, R. Asokamani, and A. K. Gogia, “Ti based biomaterials, the ultimate choice for orthopaedic implants – A review,” Progress in Materials Science, vol. 54, no. 3, pp. 397–425, May 2009, doi: 10.1016/J.PMATSCI.2008.06.004.
[20] L. H.-J. of the american ceramic society and undefined 1991, “Bioceramics: from concept to clinic,” Wiley Online Library, Accessed: Jul. 18, 2021. [Online]. Available: https://ceramics.onlinelibrary.wiley.com/doi/abs/10.1111/j.1151-2916.1991.tb07132.x
[21] “Progress in organic coatings,” Progress in Organic Coatings, vol. 45, no. 2–3. 2002.
[22] “Prótesis de cadera - Qué es, causas, síntomas, tratamiento y consejos | FisioOnline.” https://www.fisioterapia-online.com/protesis-de-cadera-que-es-causas-sintomas-diagnostico-tratamiento (accessed Aug. 10, 2021).
[23] P. Christel, L. Claes, and S. A. Brown, “Carbon-Reinforced Composites in Orthopedic Surgery,” High Performance Biomaterials, pp. 497–518, Nov. 2018, doi: 10.1201/9780203752029-32/CARBON-REINFORCED-COMPOSITES-ORTHOPEDIC-SURGERY-CHRISTEL-CLAES-BROWN.
[24] E. Schneider, C. Kinast, J. E.-… and related research, and undefined 1989, “A comparative study of the initial stability of cementless hip prostheses.,” europepmc.org, Accessed: Jul. 18, 2021. [Online]. Available: https://europepmc.org/article/med/2805480
[25] R. Huiskes, “Some Fundamental Aspects of Human Joint Replacement: Analyses of Stresses and Heat Conduction in Bone-Prosthesis Structures,” http://dx.doi.org/10.3109/ort.1980.51.suppl-185.01, vol. 51, no. Suppl. 185, 2014, doi: 10.3109/ORT.1980.51.SUPPL-185.01.
[26] S. Cleemput, S. E. F. Huys, R. Cleymaet, W. Cools, and M. Y. Mommaerts, “Additively manufactured titanium scaffolds and osteointegration - meta-analyses and moderator-analyses of in vivo biomechanical testing,” Biomaterials Research 2021 25:1, vol. 25, no. 1, pp. 1–17, Jun. 2021, doi: 10.1186/S40824-021-00216-8.
[27] D. R. Sumner, T. M. Turner, R. Igloria, R. M. Urban, and J. O. Galante, “Functional adaptation and ingrowth of bone vary as a function of hip implant stiffness,” Journal of Biomechanics, vol. 31, no. 10, pp. 909–917, Oct. 1998, doi: 10.1016/S0021-9290(98)00096-7.
[28] D. F. Williams, “Leading Opinion On the mechanisms of biocompatibility q,” 2008, doi: 10.1016/j.biomaterials.2008.04.023.
[29] J. Porter, J. V. F.-G. dentistry, and undefined 2005, “Success or failure of dental implants? A literature review with treatment considerations.,” europepmc.org, Accessed: Aug. 09, 2021. [Online]. Available: https://europepmc.org/article/med/16366052
[30] D. Petsch and F. B. Anspach, “Endotoxin removal from protein solutions,” Journal of Biotechnology, vol. 76, no. 2–3, pp. 97–119, Jan. 2000, doi: 10.1016/S0168-1656(99)00185-6.
[31] W. A. Lynn and D. T. Golenbock, “Lipopolysaccharide antagonists,” Immunology Today, vol. 13, no. 7, pp. 271–276, Jan. 1992, doi: 10.1016/0167-5699(92)90009-V.
[32] Y. An, B. Blair, K. Martin, R. F.-H. of bacterial adhesion, and undefined 2000, “Macromolecule surface coating for preventing bacterial adhesion,” Springer, Accessed: Aug. 09, 2021. [Online]. Available: https://link.springer.com/chapter/10.1007/978-1-59259-224-1_39
[33] L. Montanaro, D. Campoccia, and C. R. Arciola, “Advancements in molecular epidemiology of implant infections and future perspectives,” Biomaterials, vol. 28, no. 34, pp. 5155–5168, Dec. 2007, doi: 10.1016/J.BIOMATERIALS.2007.08.003.
[34] N. J. Hallab, S. Anderson, T. Stafford, T. Glant, and J. J. Jacobs, “Lymphocyte responses in patients with total hip arthroplasty,” Journal of Orthopaedic Research, vol. 23, no. 2, pp. 384–391, Mar. 2005, doi: 10.1016/J.ORTHRES.2004.09.001.
[35] A. Sargeant and T. Goswami, “Hip implants: Paper V. Physiological effects,” 2004, doi: 10.1016/j.matdes.2004.10.028.
[36] V. M, M. R, B. M, B. M, and C. L, “Large-sliding contact elements accurately predict levels of bone-implant micromotion relevant to osseointegration,” Journal of biomechanics, vol. 33, no. 12, pp. 1611–1618, Dec. 2000, doi: 10.1016/S0021-9290(00)00140-8.
[37] H. Grandin, S. Berner, M. D.- Materials, and undefined 2012, “A review of titanium zirconium (TiZr) alloys for use in endosseous dental implants,” mdpi.com, vol. 5, pp. 1348–1360, 2012, doi: 10.3390/ma5081348.
[38] T. Albrektsson, P.-I. Brånemark, H.-A. Hansson, and J. Lindström, “Osseointegrated Titanium Implants: Requirements for Ensuring a Long-Lasting, Direct Bone-to-Implant Anchorage in Man,” http://dx.doi.org/10.3109/17453678108991776, vol. 52, no. 2, pp. 155–170, 2009, doi: 10.3109/17453678108991776.
[39] “Additive Manufacturing Technique - an overview | ScienceDirect Topics.” https://www.sciencedirect.com/topics/engineering/additive-manufacturing-technique (accessed Aug. 10, 2021).
[40] “Fabricación aditiva de aleación Ti6Al4V mediante fusión por haz de electrones para el desarrollo de implantes para la industria biomédica | Lector mejorado de Elsevier.” https://reader.elsevier.com/reader/sd/pii/S2405844021009956?token=38300A54EDAB383A7CEB170DED2CB2745B602CBC3ACA3932CB0DE80101BE20CB0D4A8BE7B646FF08399E3AF47E56EA1A&originRegion=us-east-1&originCreation=20210720224643 (accessed Jul. 19, 2021).
[41] C. Culmone, G. Smit, P. B.-A. Manufacturing, and undefined 2019, “Additive manufacturing of medical instruments: A state-of-the-art review,” Elsevier, 2019, doi: 10.1016/j.addma.2019.03.015.
[42] X. Li, C. Wang, W. Zhang, and Y. Li, “Fabrication and characterization of porous Ti6Al4V parts for biomedical applications using electron beam melting process,” Materials Letters, vol. 63, no. 3–4, pp. 403–405, Feb. 2009, doi: 10.1016/J.MATLET.2008.10.065.
[43] S. Sing, J. An, … W. Y.-J. of O., and undefined 2016, “Laser and electron‐beam powder‐bed additive manufacturing of metallic implants: A review on processes, materials and designs,” Wiley Online Library, vol. 34, no. 3, pp. 369–385, Mar. 2016, doi: 10.1002/jor.23075.
[44] J. Ott, W. T. Jr, E. Butcher, 220,444 L Kironn - US Patent 10, and undefined 2019, “Additive manufactured conglomerated powder removal from internal passages,” Google Patents, vol. 12, 2014, Accessed: Aug. 10, 2021. [Online]. Available: https://patents.google.com/patent/US10220444B2/en
[45] M. Islam, … M. H.-A. P., and undefined 2019, “Additive manufacturing and hot fire testing of complex injectors with integrated temperature sensors,” asmedigitalcollection.asme.org, 2019, Accessed: Aug. 10, 2021. [Online]. Available: https://asmedigitalcollection.asme.org/POWER/proceedings-abstract/POWER2019/1071113
[46] Y. Zhang et al., “Additive Manufacturing of Metallic Materials: A Review,” Journal of Materials Engineering and Performance 2017 27:1, vol. 27, no. 1, pp. 1–13, May 2017, doi: 10.1007/S11665-017-2747-Y.
[47] D. S. Sodhi, “Nonsimultaneous crushing during edge indentation of freshwater ice sheets,” Cold Regions Science and Technology, vol. 27, no. 3, pp. 179–195, Jun. 1998, doi: 10.1016/S0165-232X(98)00010-X.
[48] T. Obikawa, M. Yoshino, J. S.-J. of M. Processing, and undefined 1999, “Sheet steel lamination for rapid manufacturing,” Elsevier, Accessed: Jul. 19, 2021. [Online]. Available: https://www.sciencedirect.com/science/article/pii/S0924013699000278
[49] D. W.-A. materials & processes and undefined 2003, “ULTRASONIC CONSOLIDATION OF ALUMINUM TOOLING.,” elibrary.ru, Accessed: Jul. 19, 2021. [Online]. Available: https://elibrary.ru/item.asp?id=4680496
[50] O. Harrysson, … O. C.-M. S. and, and undefined 2008, “Direct metal fabrication of titanium implants with tailored materials and mechanical properties using electron beam melting technology,” Elsevier, Accessed: Aug. 10, 2021. [Online]. Available: https://www.sciencedirect.com/science/article/pii/S0928493107000501
[51] R. Yan et al., “Electron beam melting in the fabrication of three-dimensional mesh titanium mandibular prosthesis scaffold,” nature.com, Accessed: Aug. 10, 2021. [Online]. Available: https://www.nature.com/articles/s41598-017-15564-6
[52] A. Mazzoli, M. Germani, R. R.-M. & Design, and undefined 2009, “Direct fabrication through electron beam melting technology of custom cranial implants designed in a PHANToM-based haptic environment,” Elsevier, 2008, doi: 10.1016/j.matdes.2008.11.013.
[53] “Scopus - Document details - Additive manufacturing of Ti6Al4V alloy via electron beam melting for the development of implants for the biomedical industry.” https://www-scopus-com.itm.elogim.com:2443/record/display.uri?eid=2-s2.0-85105291711&origin=resultslist&sort=plf-f&src=s&st1=+metals&nlo=&nlr=&nls=&sid=6d403948918dec5dc8e575426550499b&sot=b&sdt=cl&cluster=scofreetoread%2c%22all%22%2ct&sl=22&s=TITLE-ABS-KEY%28+metals%29&ref=%28%28processing%29%29+AND+%28biocompatible%29&relpos=73&citeCnt=0&searchTerm= (accessed Jul. 19, 2021).
[54] S. Shabalovskaya, J. Anderegg, and J. van Humbeeck, “Critical overview of Nitinol surfaces and their modifications for medical applications,” Acta Biomaterialia, vol. 4, no. 3, pp. 447–467, May 2008, doi: 10.1016/J.ACTBIO.2008.01.013.
[55] M. Niinomi, M. Nakai, and J. Hieda, “Development of new metallic alloys for biomedical applications,” Acta Biomaterialia, vol. 8, no. 11, pp. 3888–3903, Nov. 2012, doi: 10.1016/J.ACTBIO.2012.06.037.
[56] Q. Chen and G. A. Thouas, “Metallic implant biomaterials,” Materials Science and Engineering: R: Reports, vol. 87, pp. 1–57, Jan. 2015, doi: 10.1016/J.MSER.2014.10.001.
[57] I. Kirilova, M. Sadovoy, … V. P.-H., and undefined 2013, “Ceramic and osteoceramic implants: upcoming trends,” spinesurgery.ru, Accessed: Aug. 10, 2021. [Online]. Available: https://www.spinesurgery.ru/jour/article/view/668?locale=en_US
[58] M. Andreiotelli, H. J. Wenz, and R. J. Kohal, “Are ceramic implants a viable alternative to titanium implants? A systematic literature review,” Clinical Oral Implants Research, vol. 20, no. SUPPL. 4, pp. 32–47, Sep. 2009, doi: 10.1111/J.1600-0501.2009.01785.X.
[59] S. v. Dorozhkin, “Bioceramics of calcium orthophosphates,” Biomaterials, vol. 31, no. 7, pp. 1465–1485, Mar. 2010, doi: 10.1016/J.BIOMATERIALS.2009.11.050.
[60] V. Bayazit, M. Bayazit, E. B.-D. J. of N. and, and undefined 2010, “Evaluation of bioceramic materials in biology and medicine,” chalcogen.ro, vol. 7, no. 3, pp. 267–278, 2010, Accessed: Aug. 10, 2021. [Online]. Available: https://www.chalcogen.ro/267_Bayazit.pdf
[61] R. H. Khonsari, P. Berthier, T. Rouillon, J. P. Perrin, and P. Corre, “Severe infectious complications after PEEK-derived implant placement: Report of three cases,” Journal of Oral and Maxillofacial Surgery, Medicine, and Pathology, vol. 26, no. 4, pp. 477–482, Oct. 2014, doi: 10.1016/J.AJOMS.2013.04.006.
[62] D. Hak, C. Mauffrey, D. Seligson, and B. Lindeque, “Uso de implantes compuestos reforzados con fibra de carbono en cirugía ortopédica,” Ortopedia, vol. 37, no. 12, pp. 825–830, Dec. 2014, doi: 10.3928/01477447-20141124-05.
[63] D. B. McGregor, R. A. Baan, C. Partensky, J. M. Rice, and J. D. Wilbourn, “Evaluation of the carcinogenic risks to humans associated with surgical implants and other foreign bodies — a report of an IARC Monographs Programme Meeting,” European Journal of Cancer, vol. 36, no. 3, pp. 307–313, Feb. 2000, doi: 10.1016/S0959-8049(99)00312-3.
[64] J. Ling et al., “High-throughput development and applications of the compositional mechanical property map of the β titanium alloys,” Elsevier, 2021, doi: 10.1016/j.jmst.2020.07.035.
[65] H. Kabir, K. Munir, C. Wen, Y. L.-B. materials, and undefined 2021, “Recent research and progress of biodegradable zinc alloys and composites for biomedical applications: biomechanical and biocorrosion perspectives,” Elsevier, Accessed: Jul. 19, 2021. [Online]. Available: https://www.sciencedirect.com/science/article/pii/S2452199X20302334
[66] C. A. Jones, L. A. Beaupre, D. W. C. Johnston, and M. E. Suarez-Almazor, “Total Joint Arthroplasties: Current Concepts of Patient Outcomes after Surgery”, doi: 10.1016/j.cger.2005.02.005.
[67] T. Jinno, V. Goldberg, … D. D.-J. of B., and undefined 1998, “Osseointegration of surface‐blasted implants made of titanium alloy and cobalt–chromium alloy in a rabbit intramedullary model,” Wiley Online Library, Accessed: Jul. 17, 2021. [Online]. Available: https://onlinelibrary.wiley.com/doi/abs/10.1002/(SICI)1097-4636(199810)42:1%3C20::AID-JBM4%3E3.0.CO;2-Q
[68] D. A. Puleo and M. v Thomas, “Implant Surfaces”, doi: 10.1016/j.cden.2006.03.001.
[69] “Lossdorfer: Microrough implant surface topographies... - Google Académico.” https://scholar.google.com/scholar_lookup?title=Microrough%20implant%20surface%20topographies%20increase%20osteogenesis%20by%20reducing%20osteoclast%20formation%20and%20activity&publication_year=2004&author=S.%20Lossdorfer&author=Z.%20Schwartz&author=L.%20Wang&author=C.H.%20Lohmann&author=J.D.%20Turner&author=M.%20Wieland (accessed Jul. 17, 2021).
[70] “Black: Orthopaedic biomaterials in research and practice,... - Google Académico.” https://scholar.google.com/scholar_lookup?title=Orthopaedic%20Biomaterials%20in%20Research%20and%20Practice&publication_year=1988&author=J%20Black (accessed Jul. 18, 2021).
[71] Y. C.-B. orthopaedic biomechanics and undefined 1997, “Biomechanics of fracture fixation,” ci.nii.ac.jp, Accessed: Jul. 18, 2021. [Online]. Available: https://ci.nii.ac.jp/naid/10020762046/
[72] J. R. Coates, “Intervertebral Disk Disease,” Veterinary Clinics of North America: Small Animal Practice, vol. 30, no. 1, pp. 77–110, Jan. 2000, doi: 10.1016/S0195-5616(00)50004-7.
[73] “Valdevit: Methods for mechanical testing of spinal... - Google Académico.” https://scholar.google.com/scholar_lookup?title=Methods%20for%20mechanical%20testing%20of%20spinal%20constructs&publication_year=1996&author=A.D.C%20Valdevit&author=N%20Inoue&author=B.A%20MacWilliams&author=L.L%20Anderson (accessed Jul. 19, 2021).
[74] “D.M. Brunette, P. Tengvall, M. Textor, P. Thomsen,... - Google Académico.” https://scholar.google.com/scholar?q=D.M.%20Brunette,%20P.%20Tengvall,%20M.%20Textor,%20P.%20Thomsen,%20,%20Titanium%20in%20medicine.%202001,%20Springer,%20Berlin,%202001,%20doi:%2010.1007978-3-642-56486-4. (accessed Aug. 10, 2021).
[75] R. Mahabir and C. Butler, “Stabilization of the Chest Wall: Autologous and Alloplastic Reconstructions,” Seminars in Plastic Surgery, vol. 25, no. 01, pp. 034–042, Feb. 2011, doi: 10.1055/S-0031-1275169.
[76] Q. Chen and G. A. Thouas, “Metallic implant biomaterials,” Materials Science and Engineering: R: Reports, vol. 87, pp. 1–57, Jan. 2015, doi: 10.1016/J.MSER.2014.10.001.
[77] N. Hallab, K. Merritt, J. J.- JBJS, and undefined 2001, “Metal sensitivity in patients with orthopaedic implants,” journals.lww.com, vol. 83, p. 428, 2001, Accessed: Aug. 10, 2021. [Online]. Available: https://journals.lww.com/jbjsjournal/fulltext/2001/03000/metal_sensitivity_in_patients_with_orthopaedic.17.aspx
[78] J. Berthet, L. Canaud, T. D’Annoville, … P. A.-T. A. of thoracic, and undefined 2011, “Titanium plates and Dualmesh: a modern combination for reconstructing very large chest wall defects,” Elsevier, Accessed: Aug. 10, 2021. [Online]. Available: https://www.sciencedirect.com/science/article/pii/S0003497511004383
[79] E. Ingham, J. F.- Biomaterials, and undefined 2005, “The role of macrophages in osteolysis of total joint replacement,” Elsevier, Accessed: Aug. 10, 2021. [Online]. Available: https://www.sciencedirect.com/science/article/pii/S014296120400393X
[80] P. Purdue, P. Koulouvaris, … H. P.-C. O., and undefined 2007, “The cellular and molecular biology of periprosthetic osteolysis,” journals.lww.com, Accessed: Aug. 10, 2021. [Online]. Available: https://journals.lww.com/clinorthop/Fulltext/2007/01000/The_Cellular_and_Molecular_Biology_of.41.aspx
[81] E. Rombolá, “Evaluación radiológica de los elementos de osteosíntesis en el miembro superior,” Revista Argentina de Radiología, vol. 81, no. 4, pp. 285–295, Oct. 2017, doi: 10.1016/J.RARD.2016.11.007.
[82] Q. Wang, Y. Zhang, B. Li, and L. Chen, “Controlled dual delivery of low doses of BMP-2 and VEGF in a silk fibroin–nanohydroxyapatite scaffold for vascularized bone regeneration,” Journal of Materials Chemistry B, vol. 5, no. 33, pp. 6963–6972, Aug. 2017, doi: 10.1039/C7TB00949F.
[83] C. Laurencin, Y. Khan, and S. F. El-Amin, “Bone graft substitutes,” http://dx.doi.org/10.1586/17434440.3.1.49, vol. 3, no. 1, pp. 49–57, Jan. 2014, doi: 10.1586/17434440.3.1.49.
[84] N. Taniguchi et al., “Effect of pore size on bone ingrowth into porous titanium implants fabricated by additive manufacturing: An in vivo experiment,” 2015, doi: 10.1016/j.msec.2015.10.069.
[85] T. Schouman, M. Schmitt, C. Adam, G. Dubois, and P. Rouch, “Influence of the overall stiffness of a load-bearing porous titanium implant on bone ingrowth in critical-size mandibular bone defects in sheep,” Journal of the Mechanical Behavior of Biomedical Materials, vol. 59, pp. 484–496, Jun. 2016, doi: 10.1016/J.JMBBM.2016.02.036.
[86] V. de Viteri, E. F.-T.-F. and, and undefined 2013, “Titanium and titanium alloys as biomaterials,” books.google.com, Accessed: Aug. 11, 2021. [Online]. Available: https://books.google.com/books?hl=es&lr=&id=VGOfDwAAQBAJ&oi=fnd&pg=PA155&ots=-VcvKfPP89&sig=LVawq5jgJTRz1KvNTZsuUZ0cSI4
[87] V. Goriainov, R. Cook, J. Latham, D. D.-A. biomaterialia, and undefined 2014, “Bone and metal: an orthopaedic perspective on osseointegration of metals,” Elsevier, Accessed: Aug. 11, 2021. [Online]. Available: https://www.sciencedirect.com/science/article/pii/S1742706114002517
[88] M. Thieme, K. Wieters, … F. B.-J. of materials, and undefined 2001, “Titanium powder sintering for preparation of a porous functionally graded material destined for orthopaedic implants,” Springer, vol. 12, no. 3, pp. 225–231, 2001, doi: 10.1023/A:1008958914818.
[89] A. de L. Rodríguez López et al., “Preventing S. aureus biofilm formation on titanium surfaces by the release of antimicrobial β-peptides from polyelectrolyte multilayers,” Acta Biomaterialia, vol. 93, pp. 50–62, Jul. 2019, doi: 10.1016/J.ACTBIO.2019.02.047.
[90] S. Spriano, S. Yamaguchi, F. Baino, and S. Ferraris, “A critical review of multifunctional titanium surfaces: New frontiers for improving osseointegration and host response, avoiding bacteria contamination,” Acta Biomaterialia, vol. 79, pp. 1–22, Oct. 2018, doi: 10.1016/J.ACTBIO.2018.08.013.
[91] Y. Chen et al., “Manufacturing of graded titanium scaffolds using a novel space holder technique,” Bioactive Materials, vol. 2, no. 4, pp. 248–252, Dec. 2017, doi: 10.1016/J.BIOACTMAT.2017.07.001.
[92] T. v. Basova, E. S. Vikulova, S. I. Dorovskikh, A. Hassan, and N. B. Morozova, “The use of noble metal coatings and nanoparticles for the modification of medical implant materials,” Materials & Design, vol. 204, p. 109672, Jun. 2021, doi: 10.1016/J.MATDES.2021.109672.
[93] N. Patel, P. G.-I. J. of E. T. and, and undefined 2012, “A review on biomaterials: scope, applications & human anatomy significance,” Citeseer, vol. 2, no. 4, 2012, Accessed: Jul. 18, 2021. [Online]. Available: http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.413.7368&rep=rep1&type=pdf
[94] P. Hale, E. Smith, and A. Klein, “An Introduction to a New Family of Palladium Based Medical Alloys,” 2009, Accessed: Jul. 18, 2021. [Online]. Available: https://books.google.com/books?hl=es&lr=&id=LqQaGXFDdLsC&oi=fnd&pg=PA69&dq=P.+Hale,+E.+Smith,+A.+Klein,+et+al.,+An+introduction+to+a+new+family+of+palladium+based+medical+alloys,+&ots=_SShPx2jOP&sig=_xL6G8QIEgKql1_2skRJRfecpYQ
[95] C. Marambio-Jones, E. H.-J. of nanoparticle research, and undefined 2010, “A review of the antibacterial effects of silver nanomaterials and potential implications for human health and the environment,” Springer, vol. 12, no. 5, pp. 1531–1551, Jun. 2010, doi: 10.1007/s11051-010-9900-y.
[96] S. Chernousova and M. Epple, “Silver as antibacterial agent: Ion, nanoparticle, and metal,” Angewandte Chemie - International Edition, vol. 52, no. 6, pp. 1636–1653, Feb. 2013, doi: 10.1002/ANIE.201205923.
[97] T. Schmidt-Braekling, … A. S.-E. J., and undefined 2017, “Silver-coated megaprostheses: review of the literature.,” search.ebscohost.com, Accessed: Jul. 18, 2021. [Online]. Available: http://search.ebscohost.com/login.aspx?direct=true&profile=ehost&scope=site&authtype=crawler&jrnl=16338065&AN=122654598&h=o30uRNsh%2Frob8RSPdy6Elmg3GWLQfQ3czDUcfPTtAsGwvPVgccdWz3NbxlqEXKF1OXBO9lV74YI69qrs9g%2BYOw%3D%3D&crl=c
[98] L. Y. Qing, R. Li, G. Liu, … Y. Z.-I. journal, and undefined 2018, “Potential antibacterial mechanism of silver nanoparticles and the optimization of orthopedic implants by advanced modification technologies,” ncbi.nlm.nih.gov, Accessed: Jul. 19, 2021. [Online]. Available: https://www.ncbi.nlm.nih.gov/pmc/articles/pmc5993028/
[99] P. Lam, R. Wong, K. Lam, … L. H.-C., and undefined 2020, “The role of reactive oxygen species in the biological activity of antimicrobial agents: An updated mini review,” Elsevier, Accessed: Aug. 11, 2021. [Online]. Available: https://www.sciencedirect.com/science/article/pii/S0009279719313626
[100] E. T. K. Demann, P. S. Stein, and J. E. Haubenreich, “Gold as an Implant in Medicine and Dentistry,” Journal of Long-Term Effects of Medical Implants, vol. 15, no. 6, pp. 687–698, 2005, doi: 10.1615/JLONGTERMEFFMEDIMPLANTS.V15.I6.100.
[101] S. Ferraris, S. S.-M. S. and E. C, and undefined 2016, “Antibacterial titanium surfaces for medical implants,” Elsevier, Accessed: Jul. 19, 2021. [Online]. Available: https://www.sciencedirect.com/science/article/pii/S0928493115306755
[102] A. Avellan et al., “Gold nanoparticle biodissolution by a freshwater macrophyte and its associated microbiome,” Nature Nanotechnology 2018 13:11, vol. 13, no. 11, pp. 1072–1077, Aug. 2018, doi: 10.1038/s41565-018-0231-y.
[103] H. Johnston, G. Hutchison, … F. C.-C. reviews in, and undefined 2010, “A review of the in vivo and in vitro toxicity of silver and gold particulates: particle attributes and biological mechanisms responsible for the observed toxicity,” Taylor & Francis, vol. 40, no. 4, pp. 328–346, Apr. 2014, doi: 10.3109/10408440903453074.
[104] X. Gu et al., “Preparation and antibacterial properties of gold nanoparticles: a review,” Springer, vol. 19, no. 1, p. 21567014, Feb. 2020, doi: 10.1007/s10311-020-01071-0.