1. INTRODUCCIÓN
Los humedales son ecosistemas terrestres saturadas o inundadas de agua de forma permanente, esta situación favorece el desarrollo de una amplia diversidad de flora, fauna y microorganismos que sostienen a la humanidad y a la naturaleza. Manteniendo nuestro desarrollo social y económico a través de diversos servicios[1] Por ello, cuando las condiciones ecológicas de los ambientes acuáticos no han sufrido alteraciones drásticas e irreversibles, se presenta en ellos una compleja red trófica, producto de su desarrollo evolutivo a través del tiempo y el espacio. La base de tal red se apoya en la existencia de una singular composición florística, situación que resulta atractiva para diversos grupos de fauna silvestre que aprovechan la oferta de refugio y concentración constante de alimento en la zona; de allí que el hombre, ha accedido a disfrutar de los múltiples servicios ambientales que estos ecosistemas le proporcionan>[2] Dentro de la situación enunciada atrás, se enmarcan los humedales de la cuenca media del río Atrato, que además son considerados uno de los ecosistemas de humedales internos de mayor importancia de Colombia [3]
En este tipo de ecosistemas, una de las actividades que en los últimos tiempos ha contribuido con el deterioro de la calidad del agua y de las comunidades biológicas acuáticas, es la minería; la cual, es una actividad que ha presentado un importante crecimiento durante los últimos años en la que se considera a la minería como un mecanismo de desarrollo económico y social para el país [4]
Colombia, es considerado como uno de los países con mayor diversidad ecológica, ha visto a través de su historia como la actividad minera ha degradado su patrimonio natural debido a los excesos en la explotación e inadecuados procesos industriales [5]. En el caso del departamento del Chocó, la actividad minera ha impactado las fuentes hídricas superficiales por manejo inadecuado de aguas al interior de la mina, por aumento en los sólidos disueltos y turbidez por partículas en suspensión y en arrastre; afectación de las rondas y cauces de los ríos y la red de drenajes natural, alterando su dinámica fluvial y equilibrio hidrológico; desaparición de cuerpos de agua como quebradas y manantiales; estos impactos pueden ser de carácter directo, en algunos casos a largo plazo y en otros casos puede ser irremediable (Fierro, 2012) [6].
En la evaluación del deterioro de los ecosistemas acuáticos como en los humedales, se han utilizado diferentes organismos, entre los cuales los macroinvertebrados han sido los más recomendados (Roldán 1999 [7], Bonada et al., 2006 [8], Prat et al., 2009 [9]), puesto que pueden indicar características específicas, no solo de las condiciones actuales, sino también de las que se han presentado con anterioridad (meses o años atrás) en el medio donde se encuentran, debido a las ventajas que presentan: su distribución prácticamente universal, sus hábitos relativamente sedentarios, la alta sensibilidad de algunos a las perturbaciones, sus ciclos de vida que tienden a ser largos, sus reacciones rápidas frente a determinados impactos, la existencia de un patrón conocido para muchas especies de estímulo-respuesta ante alteraciones físico-químicas, la disponibilidad de métodos de evaluación y el conocimiento relativamente aceptable de su taxonomía para algunas regiones del mundo (Rosenberg & Resh, 1996[10], lo que los convierte en herramientas ideales para la evaluación de diferentes tipos de deterioro en un sin número de ambientes acuáticos, entre ellos los humedales.
En este sentido, mediante la valoración de la comunidad de macroinvertebrados se pueden deducir aspectos del ecosistema acuático tales como los niveles de oxígeno y el grado de contaminación orgánica [11], así como el estado de eutrofización del sistema [12]. Además, estos organismos permiten conocer, con aceptable precisión, el grado de autodepuración y las zonas de mayor o menor grado de saprobiedad en los sistemas lóticos [13].
De acuerdo a lo anterior, el presente artículo tiene como objetivo conocer el efecto de la contaminación minera (aurífera) sobre el ensamblaje de macroinvertebrados acuáticos en la ciénaga Plaza Seca, cuenca Media del Atrato, Chocó, Colombia, zona que es considerada un área estratégica, en términos de servicios ambientales y con relaciones ecológicas frágiles entre cadenas tróficas, es importante revertir estos daños para garantizar la continuidad en la prestación de los servicios ambientales del ecosistema y por tanto un desarrollo sustentable de la region.
2. MATERIALES Y METODO
Área de estudio
La presente investigación se realizó en la ciénaga de Plaza Seca del corregimiento de San ceno, perteneciente al municipal de Quibdó, Chocó, Colombia en la Cuenca del rio Atrato, medio. Esta ciénaga se ubica entre los 5º45'15,5" N, 76º42'42,1" W a 43 m.s.n.m.; presenta una precipitación promedio anual de 8000 mm, temperatura promedio de 26,8 °C y una humedad relativa del 85,7%, correspondiendo a una zona de vida de bosque muy húmedo tropical (bmh-T) [14].
Establecimiento de zonas de muestreo
Para el muestreo de los macroinvertebrados acuáticos se establecieron cuatro puntos de muestreo a lo largo de todo el humedal de forma aleatoria para garantizar la homogeneidad, se ubicaron transeptos perpendiculares a la línea de borde, en los cinturones de macrófitas y se utilizó un cuadrante de PVC, dotado de una malla de 0,5mm; ésta se ubicó bajo la superficie a colectar.
Técnicas de captura
Posterior al establecimiento de los cuatro puntos de muestreo se procedió a la captura y recolección de los especímenes, para tal fin, se emplearon dos técnicas: capturas por draga y cernidores manuales. La captura por draga, se realizó utilizando dragas Ekman con tres lanzamientos por punto Las muestras recolectadas fueron lavadas y cernidas en un tamiz con apertura de malla de 0,5 mm. La captura por cernidores manuales, se realizó utilizando un cuadrante de PVC, dotado de una malla de 0,5mm; ésta se ubicó bajo la superficie a colectar.
Se realizaron dos muestreos por mes con intervalos de 15 días durante cuatro meses. Las capturas realizaron de 8:00 am a 1:00 pm donde se inspecciono cada sitio de muestreo. Las capturas manuales se usó la malla de 0,5mm; ésta se ubicó bajo la superficie a colectar, se extrajeron las plantas y se lavaron cuidadosamente las raíces para remover los organismos allí presentes, la intensidad de muestreo fue de 40horas/ hombre. Durante cada muestreo se realizaron mediciones de variables físicas, químicas e hidrológicas in situ
Identificación y preservación de los macro invertebrados colectados
Los macro invertebrados fueron identificados hasta la categoría taxonómica de género. Para esto se utilizaron elementos como: estéreo microscopio, microscipio, estereoscopio para observar estructuras difíciles visualizar, se emplearon claves de diferentes especialistas como: [15], Domínguez [16]., Domínguez y Fernández [17].
El proceso de identificación, se realizó mediante la observación de algunas características estructurales como: ocelos, labros, mandíbulas, palpo, antenas, coxa, agallas, pronoto, abdomen y filamento terminal, Al igual que comparaciones con insectos presentes en la colección linnológica de la UTCH donde reposan hasta el momento Después de la identificación, los insectos fueron separados por morfo especie teniendo en cuenta el género al cual pertenecían, se etiquetaron y se depositaron en frascos con alcohol al 70%
Análisis de la información
Para determinar la representatividad de los muestreos realizados, se calcularon los estimadores de diversidad (Chao 1, Bootstraps y Cole), con el programa Stimates 9.0., utilizando cada punto como una unidad de muestreo [18].
Las variables físicas y químicas del
agua se les aplicó un análisis de estimación de la media aritmética (![]() ) y la desviación estándar. Para los cambios espaciales se aplicó un
Análisis de Varianza (ANOVA) las diferencias temporales se evaluaron mediante
una prueba t de dos muestras
) y la desviación estándar. Para los cambios espaciales se aplicó un
Análisis de Varianza (ANOVA) las diferencias temporales se evaluaron mediante
una prueba t de dos muestras
La estructura del ensamblaje se determinó con los índices de diversidad de Shannon - Weaver y Dominancia de Simpson, riqueza específica, abundancia total y relativa. Los cambios en los índices ecológicos entre puntos y muestreos se evaluaron con un ANOVA multifactorial
3. RESULTADOS
Composición de macroinvertebrados acuáticos de la ciénaga plaza seca
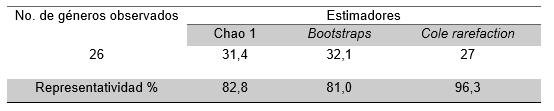
Los estimadores no paramétricos utilizados (Chao1, Bootstraps y Cole rarefaction), indicaron que la representatividad de los muestreos estuvo entre el 81 y el 96,30% de los géneros de macroinvertebrados acuáticos esperados en las macrófitas de la ciénaga estudiada (Tabla 1).
Tabla 1. Estimadores de riqueza de taxa de la comunidad de macroinvertebrados en la ciénaga Plaza Seca
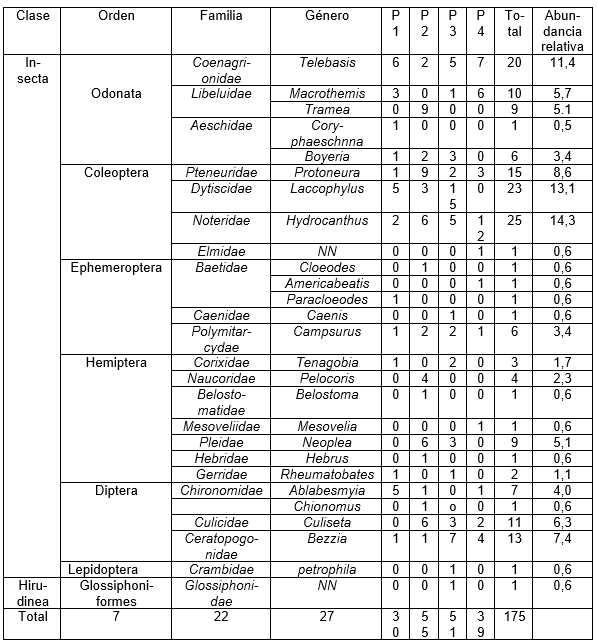
La presente investigación dio como resultado La comunidad de macroinvertebrados acuáticos en la ciénaga estuvo representada por 175 organismos, distribuidos en 2 clases, 7 órdenes, 22 familias y 27 géneros (Tabla 2). La clase insecta fue la más representativa con el 99,42% de los individuos. A nivel de órdenes, Odonata fue el más representativo con el 34,86%, seguido de Coleóptera con el 28,0% y Diptera con el 18,29% y en menor proporción los órdenes Neuróptera y Glossiphoniformes (ambos con el 0,57%) (Figura 1a).
Las familias más representativas según la cantidad de individuos colectados fueron: Noteridae con el (14%), Dytiscidae (13%), Coenagrionidae (11%) y Libellulidae (10,%); Por otro lado, las de menor representatividad fueron: Corixidae, Baetidae y Gerridae todas con valores inferiores al (2%) (Figura 3b). A nivel de géneros, sobresalen los géneros Hydrocanthus (14%), Laccophylus (13%) y Telebasis (11%), el resto de géneros presentan abundancias relativas inferiores al 10% (Tabla 2).
Tabla 2. Composición taxonómica de la comunidad de macroinvertebrados acuáticos producto de dos muestreos realizados en la ciénaga La Negra, Quibdó – Chocó
Fuente: Elaboración propia por los autores.
Estructura del ensamblaje de macroinvertebrados acuáticos
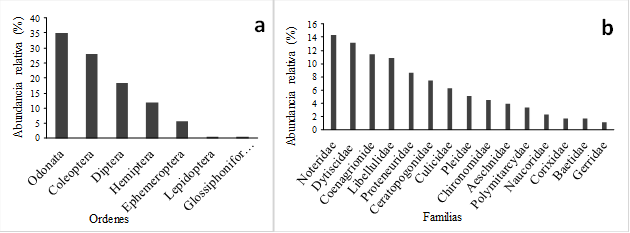
Figura 1. a) Abundancia relativa a nivel de órdenes. b) Abundancia relativa a nivel de familias de macroinvertebrados acuáticos>
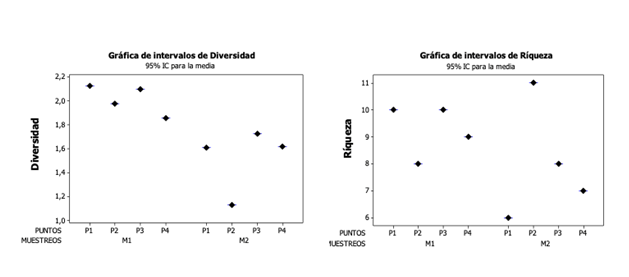
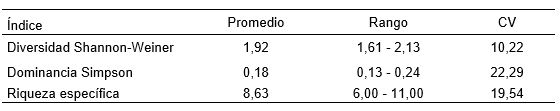
Al evaluar la estructura de la comunidad de macroinvertebrados en la ciénaga de estudio, se encontró que el índice de Diversidad de Shannon-Weiner presentó un valor promedio de 1,92 bits/ind, exhibiendo los mayores valores (2,13bits/ind) en el punto 1 durante el primer muestreo y los más bajos (1,61 bits/ind) en el punto 1 durante el segundo muestreo. Se presentaron diferencias significativas en la diversidad entre muestreos (F= 14,02; p= 0,033), pero no entre puntos (F= 1,48; p= 0,377) (Figura 2).
Figura 2. Variación espacial y temporal de la diversidad y riqueza de macroinvertebrados acuáticos en la ciénaga Plaza Seca.
La riqueza de taxa, presentó un valor promedio de 8,6 taxones, exhibiendo los mayores valores (11 taxones) en el punto 2 durante el segundo muestreo y los más bajos (6 taxones) en el punto 1 durante el segundo muestreo (ver Tabla 3). No se presentaron diferencias significativas en la riqueza entre muestreos (F= 0,70; p= 0,464), ni entre puntos (F= 0,25; p= 0,856) (ver Figura 3).
Por otro lado, los bajos valores de diversidad se hayan asociados a las actividades mineras que se desarrollan en las áreas aledañas a la ciénaga estudiada, las cuales causan modificaciones en el hábitat y la topografía natural de los ambientes acuáticos, Todo esto altera los procesos fisicoquímicos y bióticos de los ecosistemas acuáticos, constituyendo compuestos letales para las larvas de insectos que son el principal componente de los macroinvertebrados acuáticos [20].
El índice de dominancia de Simpson tuvo un valor promedio de 0,18, presentando los mayores valores (0,24) en el punto 1 durante el segundo muestreo y los más bajos (0,13) en el punto 1 durante el primer muestreo. Se presentaron diferencias significativas en la dominancia entre muestreos (F= 13,71; p= 0,034), pero no entre puntos (F= 0,54; p= 0,689) (Figura 5). Los valores de dominancia de Simpson registrados son bajos, lo que demuestra que la diversidad y la riqueza de especies es igualmente baja, ya que se encuentran pocos taxones y la cantidad de individuos con que cuenta cada uno es muy bajo.
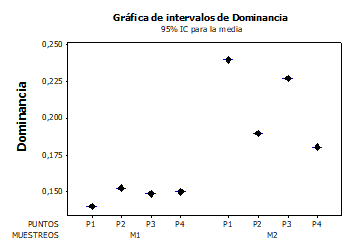 |
Figura 3. Variación espacial y temporal de la dominancia de macroinvertebrados acuáticos en la ciénaga Plaza Seca.
Tabla 3. Valores promedio, rango y coeficiente de variación (CV), de los índices ecológicos medidos durante dos muestreos realizados en cuatro estaciones de muestreo ubicadas en la ciénaga La Negra, Quibdó – Chocó.
Fuente: Elaboración propia por los autores.
Dinámica del ensamblaje de macroinvertebrados acuáticos en los puntos de muestreo de la ciénaga estudiada
El mayor número de especímenes se colecto en el primer muestreo con 88 especímenes (50%), así como la mayor riqueza específica con 20 con los coleópteros, odonatos y dípteros como los más representativos (Figura 4a). Esto se debió a que en el muestreo 1 se presentaron cambios en las condiciones ambientales, tales como la disminución en la precipitación que incluyen condiciones físicas, y aspectos ecológicos como los sustratos naturales, los cuales son los principales hábitats de los macroinvertebrados acuáticos en los cuerpos de agua según [21].
A nivel de puntos de muestreo, el punto 2 fue el que presentó mayor número de individuos con el 31% (55 individuos), así como la mayor riqueza específica con 16 géneros (59%), sobresaliendo los odonatos y hemípteros, mientras que en el punto 1 se presentó el valor más bajo con el 17% (30 individuos) en el que se destacan los odonatos y dípteros (Figura 4b). La mayor abundancia y riqueza observada en el punto 2 de la ciénaga puede estar asociada a la mayor presencia de parches de macrófitas en este punto a diferencia de punto 1. De acuerdo con [22]
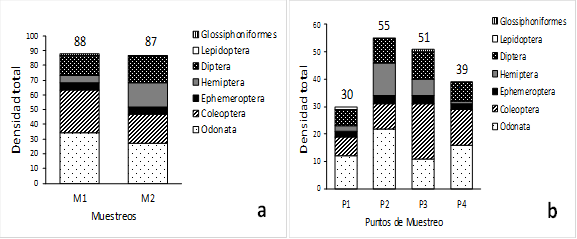
Figura 4. Densidad total a nivel de muestreos (a) y de puntos de muestreo (b).
Análisis fisicoquímico
Dinámica fisicoquímica y contaminación minera en la ciénaga estudiada
Tabla 4. Valores promedio, rango y coeficiente de variación (CV), valores máximos y mínimos de las variables fisicoquímicas e hidrológicos por muestreo en la ciénaga de Plaza Seca, Quibdó – Chocó.
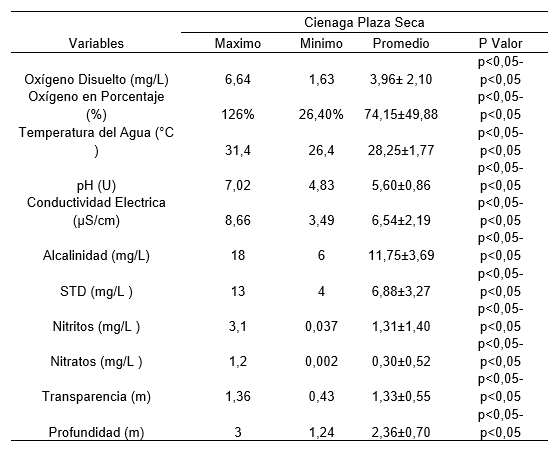
El oxígeno disuelto y el porcentaje de saturación presentaron sus máximos valores de 6,64 mg/L y 126% respectivamente en el punto 4 durante el muestreo 1 y un mínimo valor de 1,63 mg/L y 26,40% en el punto 1 durante el muestreo 2 ; con promedio de 3,96± 2,10 mg/L y 74,15±49,88 % respectivamente. Existiendo diferencias estadísticas significativas entre muestreos (p<0,05), pero no entre puntos (p>0,05) para ambos parámetros . El punto 4 de la ciénaga Plaza Seca corresponde a la zona limnética de este tipo de ecosistemas, la cual corresponde a la zona más iluminada y por ende de mayor producción de oxígeno por parte del fitoplancton, lo que ayuda a explicar los mayores valores de oxígeno en este punto. [23]
La temperatura del agua presentó su máximo valor de 31,40 °C en el punto 1 durante el muestreo 1 y un mínimo valor de 26,40 °C en el punto 1 durante el muestreo 2; con promedio de 28,25±1,77 °C. No existiendo diferencias entre muestreos (p>0,05), ni entre puntos (p>0,05).
El pH presentó su máximo valor de 7,02 unidades de pH en punto 1 durante el muestreo 1 y un mínimo valor de 4,83 unidades de pH en el punto 4 durante el muestreo 2; con promedio de 5,60±0,86 unidades de pH. No existiendo diferencias entre muestreos (p>0,05), ni entre puntos (p>0,05). En el caso del pH, los valores ligeramente ácidos pueden ser atribuidos a la naturaleza de los suelos de la zona, los cuales son ácidos al igual que los de la mayoría del departamento del Chocó; igualmente, los valores de pH se encuentran también asociados a la actividad minera en la zona, la cual tiende a acidificar el agua como consecuencia de la oxidación e hidrólisis de sulfuros con formación de sulfatos y sulfatos ácidos (drenaje ácido de mina) lo cual constituye uno de los mayores problemas que representa la minería. Sin embargo, los valores registrados siguen estando dentro los límites para la supervivencia de los organismos acuáticos que es de entre 4,5 a [24].
La conductividad eléctrica presentó su máximo valor de 8,66 µS/cm en el punto 2 durante el muestreo 1 y un mínimo valor de 3,49 µS/cm en el punto 3 durante el muestreo; con promedio de 6,54±2,19 µS/cm . Existiendo diferencias entre muestreos (p<0,05), pero no entre puntos (p>0,05). Los valores de alcalinidad se encuentran dentro de los rangos normales para ecosistemas neotropicales, menores de 1500 μS/ [24]
La alcalinidad presentó su máximo valor de 18,0 mg/L CaCO3 en el punto 3 durante el muestreo 2 y un mínimo valor de 6,0 mg/L CaCO3 en el punto 3 durante el muestreo 1; con promedio de 11,75±3,69 mg/L CaCO3. No se evidenciaron diferencias entre muestreos (p>0,05), ni entre puntos (p>0,05). Los valores de alcalinidad en la ciénaga estudiada se encuentran asociados a los cambios de pH que se generan como resultado de los procesos de tipo minero [41]. Los sólidos totales disueltos presentaron su máximo valor de 13,0 mg/L en el punto 2 durante el muestreo 2 y un mínimo valor de 4,0 mg/Len los puntos 3 y 4 de ambos muestreos ; con promedio de 6,88±3,27 mg/L. No existiendo diferencias entre muestreos (p>0,05), ni entre puntos (p>0,05). Los sólidos totales disueltos se hayan asociados a las condiciones climáticas en relación a la precipitación en la zona de estudio
Los nitritos presentaron su máximo valor de 3,10 mg/L en el punto 2 durante el muestreo 1 y un mínimo valor de 0,037 mg/Len el punto 2 durante el muestreo 2; con promedio de 1,31±1,40 mg/L; mientras que en el caso de los nitratos, su máximo valor de 1,20 mg/L en el punto 4 durante el muestreo 2 y un mínimo valor de 0,002 mg/Len el punto 1 durante el muestreo 1; con promedio de 0,30±0,52 mg/L.En el caso de los nitritos, existieron diferencias entre muestreos (p<0,05), pero no entre puntos (p>0,05); mientras que, para el caso de los nitratos, no existieron diferencias entre muestreos (p>0,05), ni entre puntos (p>0,05) . Los valores promedio de estas dos variables se encuentran por encima del nivel normal para aguas naturales (0,3 a 0,5 mg/L, [25], lo se encuentra asociado a las actividades mineras desarrolladas, las cuales están ligadas en la mayoría de los casos los asentamientos mineros se hayan asociados a asentamientos humanos en los que las fuentes hídricas son usadas como desagües o botaderos de desechos orgánicos los cuales contribuyen al incremento de las formas de Nitrógeno en el agua.
La transparencia del agua presentó su máximo valor de 1,36 m en el punto 4 durante el muestreo 2 y un mínimo valor de 0,43 mel punto 2 durante el muestreo 1; con promedio de 1,33±0,55 m; mientras que en el caso de la profundidad, su máximo valor de 3 m en el punto 1 durante el muestreo 1 y un mínimo valor de 1,24 m el punto 3 durante el muestreo 1 (Anexo 1); con promedio de 2,36±0,70 m .No existiendo diferencias entre muestreos (p>0,05), ni entre puntos (p>0,05)
Relación entre estructura y dinámica del ensamblaje de macroinvertebrados acuáticos y la dinámica fisicoquímica de la ciénaga estudiada
El Análisis de Componentes Principales (ACP) aplicado para analizar la relación entre la estructura y dinámica del ensamblaje de macroinvertebrados y la dinámica fisicoquímica en la ciénaga La Negra, afectada por minería, identificó tres componentes principales que explican el 79% de la variación de los datos (Figura 5): un primer componente que explica el 43% de la variación, determinado por las variables oxígeno disuelto, porcentaje de saturación, conductividad, nitritos, riqueza, diversidad y dominancia con correlación positiva y transparencia con correlación negativa; un segundo componente que explica el 19% de la variación, determinado por las variables Sólidos Totales Disueltos (STD) pH, profundidad, abundancia, y riqueza con correlación positiva; y un tercer componente (no graficado) que explica el 15% de la variación, con las variables sólidos totales disueltos, y abundancia con correlación negativa y la variable pH con correlación positiva.Esta asociación entre las variables ambientales y la comunidad de macroinvertebrados acuáticos ha sido resaltada en estudios como [26]
En el caso del pH, la mayoría de los organismos acuáticos tienen un límite de pH dentro del cual su crecimiento se hace posible, habiendo muy pocas especies que puedan crecer en pH inferiores a 2 o superiores a 10; y en el caso particular de los macroinvertebrados, el pH óptimo se haya en el rango de 5,0 a 9, [24]. Por otro lado, variables como la alcalinidad y los sólidos afectan significativamente la distribución de los macroinvertebrados, ya que tienen efectos ecofisiológicos sobre sus procesos de osmoregulación y por ende sobre su supervivencia en los ambientes acuáticos [27], [28], [24]). De esta manera, se ha evidenciado que la minería aurífera realizada en las áreas aledañas a la ciénaga estudiada, tiene efectos bastante perjudiciales sobre el ensamblaje de macroinvertebrados acuáticos, que se evidencian en la reducción en la abundancia y riqueza de taxones, así como en el cambio en su composición taxonómica, todo esto asociado a los cambios que ocasiona esta actividad en las condiciones fisicoquímicas del agua en la ciénaga y por consiguiente en su calidad.
Fuente: Elaboración propia por los autores.
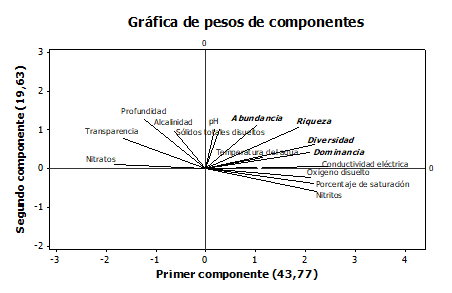 |
Figura 5. Análisis de componentes principales (ACP) de las variables fisicoquímicas y la estructura y dinámica del ensamblaje de macroinvertebrados acuáticos.
4 DISCUSIÓN
La composición y abundancia de macroinvertebrados acuáticos reportada presenta similitud con estudios realizados para otras ciénagas del departamento como los estudios de Mosquera y Córdoba [29], Mosquera [30] y Mosquera [31] y difiere de algunos en el país como [32],[ 28], [33] y [25]; estas diferencias observadas pueden ser atribuidas al reemplazo de taxones de macroinvertebrados acuáticos como resultado de los cambios generados por la actividad minera que se desarrolla en las áreas aledañas a la ciénaga estudiada; puesto que esta actividad provoca turbidez, disminuciones de oxígeno disuelto, la cual no es tolerada por la mayoría de grupos de macroinvertebrados[34].
Igual mete [19] asegura que las condiciones ambientales Como la disminución en la precipitación que incluyen condiciones físicas, y aspectos ecológicos como los sustratos naturales, los cuales son los principales hábitats de los macroinvertebrados acuáticos en los cuerpos de agua permiten mayor abundancia en la colepta de organismos en las macrófitas durante los momentos de baja precipitación.
Los valores de diversidad bajos (H' < 2,70) se hayan asociados a las actividades mineras que se desarrollan en las áreas aledañas a la ciénaga estudiada, de acuerdo con autores como [35], [36], las alteraciones de origen antrópico como la minería alteran directa e indirectamente la diversidad de insectos al interior de los ecosistemas acuáticos.
Resultados similares son reportados por Mosquera y Córdoba [37] y Mosquera [38]; quien, en investigaciones realizadas en ciénagas del departamento, reportan la mayor
Las macrófitas ofrecen un sustrato potencialmente estable para la colonización de los macroinvertebrados acuáticos, al propiciar una mayor disponibilidad de microhábitats y una diversidad de ítems alimenticios. Al respecto, algunas investigaciones han demostrado que la complejidad de este tipo de vegetación explica significativamente atributos de los ensamblajes de invertebrados asociados con la misma, tales como densidad, diversidad y patrones de abundancia relativa [39]; [40]; [41].
Dinámica fisicoquímica y contaminación minera en la ciénaga estudiada
Los valores de temperatura del agua registrados se encuentran dentro de los rangos normales para este tipo de ecosistemas segun lo reportado por [39]. Y [40], los ecosistemas tropicales, se caracterizan por presentar condiciones estables de temperatura, a diferencia de las que ocurren en las zonas templadas debido a los cambios estacionales.[24]
Por otro lado, variables como la alcalinidad y los sólidos afectan significativamente la distribución de los macroinvertebrados, ya que tienen efectos ecofisiológicos sobre sus procesos de osmoregulación y por ende sobre su supervivencia en los ambientes acuáticos [40], [23], [42]). De esta manera, se ha evidenciado que la minería aurífera realizada en las áreas aledañas a la ciénaga estudiada, tiene efectos bastante perjudiciales sobre el ensamblaje de macroinvertebrados acuáticos, que se evidencian en la reducción en la abundancia y riqueza de taxones, así como en el cambio en su composición taxonómica, todo esto asociado a los cambios que ocasiona esta actividad en las condiciones fisicoquímicas del agua en la ciénaga y por consiguiente en su calidad.
La diversidad exhibida por el ensamblaje de macroinvertebrados acuáticos fue baja durante todo el estudio, como resultado del impacto generado por la actividad minera y de la capacidad de respuesta del ensamblaje a este tipo de perturbación en la zona. En términos generales, la mayoría de las variables fisicoquímicas son afectadas fuertemente por el aumento de sedimentos generados como resultado de la actividad minera, los cuales alteraron de forma significativa la dinámica fisicoquímica de la ciénaga estudiada. El análisis de componentes principales identificó tres componentes principales que explican el 79,09% de la variación de los datos biológicos y fisicoquímicos, determinando a las variables oxígeno disuelto, porcentaje de saturación de oxígeno, conductividad eléctrica, nitritos, riqueza, diversidad y dominancia con correlación positiva y transparencia con correlación negativa, lo que se encuentra asociado al hecho de que estas variables son fuertemente afectadas de forma negativa por los procesos mineros.
6. AGRADECIMIENTOS
Agradecemos inicialmente al centro de biodiversidad y habita y a la vicerectoria de investigación de la universidad Tecnológica del Chocó por la financiaciión de este proyecto Al Instituto de Investigaciones Ambientales del Pacífico por facilitarnos sus equipos, Al grupo de profesionales del laboratorio de Limnología de la UTCH, por su apoyo en la identificación taxonómica de las especies que fueron objeto de estudio de la investigación.
7. REFERENCIAS BIBLIOGRÁFICAS
[1] Regalado, j. (2021).Humedales Museo de historia natural gustavo orcés v. escuela politécnica nacional la floresta , Quito 1-2p http://bibdigital.epn.edu.ec/bitstream/15000/21338/1/Triptico_Humedales_Ramsar_Ecuador.pdf.
[2] Castellanos M. C. A. (2015). Los ecosistemas de humedales en Colombia. Revista Luna Azul (On Line), (13), 1 de 5. Recuperado a partir de https://revistasojs.ucaldas.edu.co/index.php/lunazul/article/view/1478, 1-15p
[3] Ministerio del Medio Ambiente. (2001). Política Nacional para humedales interiores de Colombia: Estrategias para su conservación y uso racional. Primera Edición: Bogotá D.C. 67 pp.
[4] Miranda Guevara, C. J. (2018). Evaluación de la calidad del agua mediante macroinvertebrados en el tramo Padre Carollo-Paus de la microcuenca hidrografica del Río Blanco, Morona Santiago. (Tesis de grado. Ingeniero Forestal). Repositorio Institucional - Universidad Escuela Superior Politécnica de Chimborazo. Riobamba. http://dspace.espoch.edu.ec/handle/123456789/8765
[5] Murillo, Aguirre, A (2017). Afectaciones económicas y ecológicas generadas por el vertimiento de aguas residuales en la perforación exploratoria de hidrocarburos en campos de Casanare durante el periodo 2010-2015 (Tesis Maestría en Desarrollo Sostenible y Medio Ambiente) Repositorio Institucional Universidad de Manizales. https://ridum.umanizales.edu.co/xmlui/handle/20.500.12746/3513
[6] Fierro, J. (2012). Políticas mineras en Colombia. ILSA. 258 p
[7] Roldán, G. (1999). Los macroinvertebrados y su valor como indicadores de la calidad del agua. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 23(88), 375 – 386.
[8] Bonada, N., Prat, N., Resh, V.H. & Statzner, B. (2006). Developments in aquatic insect biomonitoring: A comparative analysis of recent approaches. Annual Review of Entomology 51, 495-523.
[9] Prat, N., Ríos, B., Acosta, R. & Rieradevall, M. (2009). Los macroinvertebrados como indicadores de calidad de las aguas. En Domínguez, E. & Fernández, H.R. (Eds.). Macroinvertebrados bentónicos sudamericanos. Sistemática y biología. Fundación Miguel Lillo, Tucumán, Argentina. 26 pp.
[10] Rosenberg, D.M &Resh, V.H. (1996). Use of aquatic insects in biomonitoring. Pp. 87-97. In Merrit R. W. & Cummins, W.K. (Eds). Aquatic insects of North American., 3ª ed. Kendall / Hunt Publishing. Company. Dubuque, lowa.
[11] Roldán, G. (2003). Bioindicación de la calidad del agua en Colombia. Uso del método BMWP/Col. Universidad de Antioquia, Medellín, Antioquia, Colombia
[12] Smith, A.J., Bode, R.W. &Kleppel, G.S. (2007). A nutrient biotic index (NBI) for use with benthic macroinvertebrate communities. Ecological Indicators 7, 371-386.
[13] Pinilla, G. A. (2000). Indicadores biológicos en ecosistemas acuáticos continentales de Colombia. Universidad Jorge Tadeo Lozano. 67 pp.
[14] Rangel, J.O. (2004). Colombia Diversidad Biótica IV: El Chocó Biogeográfico/Costa Pacífica. Universidad Nacional de Colombia. Bogotá. Ed. UNAL. 996 p.
[15] Merritt, R.W.; Cummins, K.W. & Berg, M.B. (2008). An introduction to the aquatic insects of North America. Dubuque, Kendall/Hunt Publishing Company. 1214 pp.
[16] Domínguez, E., Molineri, C., Pescador, M.I., Hubbard, M.D. & Nieto, C. (2006). Ephemeroptera of South América. En Aquatic Biodiversity en latin América (ABLA). Adis, J., Arias, J. R., Rueda-Delgado, G. & Wantzen, K. M. (eds). Vol. 2. Pensoft, Sofia-Moscow.
[17] Domínguez, E. & Fernández, H.R. (Ed.). (2009). Macroinvertebrados Bentónicos Sudamericanos. Tucumán, Argentina. Fundación Miguel Lillo. 654 pp.
[18] Villarreal, H., Alvarez, M., Cordoba, S., Escobar, F., Fagua, G., Gast, F., Mendoza, H., Ospina, M. & Umaña, A. M. (2004). Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa inventarios de Biodiversidad. Instituto de investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, Colombia. 236 pp.
[19] Margalef, R. (1998). Ecología. Ediciones Omega, SA. Barcelona. España, 320 p.
[20] De Marmels, J. (2003). Odonatos. En Aguilera, M., Azocar A. & Gonzales-Jiménez, E (Eds.). Biodiversidad en Venezuela. Pp. 312-325. Fundación Polar, Ministerio de Ciencia y Tecnología y Fondo Nacional de Ciencia, Tecnología e Innovación, Caracas, Venezuela.
[21] Arias, P.A. (1985). Las ciénagas en Colombia. Divulgación Pesquera, 22 (3-5), 38-70
[22] Collier KJ, Wilcock RJ, Meredith AS. 1998. Influence of substrate type and physicochemical conditions on Macroinvertebrate faunas and biotic indices of some lowland Waikato, New Zealand, streams. New Zealand Journal of Marine and Freshwater Research. 32 (1): 1-19. URL disponible en: http://dx.doi.org/10.1080/00288330.1998.9516802.
[23] Corredor, M, L, Galarza,B,G., Hernandez, A, E., Macariz, I., Tamayo, M,A y Vallejo,M.(2016). Análisis físicos y químicos en cuatro ecosistemas acuáticos en el valle del cauca, Colombia ( Informe de campo) Bo-gotá: Universidad Nacional de Colombia. 102 p
[24] Roldán G, Ramírez JJ. 2008. Fundamentos de limnología neotropical. 2ª ed. Medellín: Universidad de Antioquia-ACCEFYN-Universidad Católica de Oriente; 440 pp.
[25] Manjarrés-Hernández A, Flórez-Leiva AL, Rueda-Delgado G. 2004. Macrófitas acuáticas de la ciénaga de San Antonio-Magdalena, Colombia. En: ACL-Limnos (ed.). Resúmenes VI Seminario Nacional de Limnología y I Encuentro Internacional sobre Embalses Neotropicales. Universidad Pontificia Bolivariana-Asociación Colombiana de Limnología, Montería, Colombia; p. 75.
[26] Rúa-García, G. (2015). Macroinvertebrados acuáticos asociados a raíces de Eichhornia crassipes (Mart) Solms, en la ciénaga de Zapayán, Magdalena-Colombia. Revista Intropica, 10,52-59.
[27] Montoya, M., Vélez,F y Aguirre, Ramirez, N. (2011). Características morfométricas de un lago de plano inundable tropical (ciénaga Hoyo Los Bagres, Colombia). Fac. Ing. Univ. Antioquia,(59 ) pp. 203-214.
[28] Quiróz JA, Dueñas PR, Ballesteros J. 2010. Macroinvertebrados asociados a las raíces de Eichhornia crassipes (Mart). Solms, en dos sectores del complejo cenagoso del Bajo Sinú, departamento de Córdoba, Colombia. Rev Asoc Colomb Cienc. 22: 147-57. URL disponible en: http://www.academia.edu/2630834/Macroinvertebrados_asociados_a_las_ra%C3%ADces_de_Eichhornia_crassipes_Mart_._Solms_en_dos_sectores_del_complejo_cenagoso_del_Bajo_Sin%C3%BA_Departamento_de_C%C3%B3rdoba_Colombia
[29]Mosquera-Murillo, Z. & Córdoba Argón, K.E. (2015). Caracterización de la comunidad de macroinvertebrados acuáticos en tres ciénagas de la cuenca media del río Atrato, Chocó, Colombia. Revista Institucional Universidad Tecnológica del Chocó Investigación, Biodiversidad y Desarrollo, 34(1), 22-35.
[30]Mosquera-Murillo, Z. (2017). Insectos acuáticos asociados a raíces de Eichhornia crassipes (MART) Solms en ciénagas del río Atrato, Chocó – Colombia. Revista de Ciencias Univalle, 21(2), 29-44.
[31]Mosquera-Murillo, Z. (2018). Insectos acuáticos asociados a Eichhornia azurea (Schwartz) Kunth en ciénagas del río Atrato, Chocó – Colombia. Revista Colombiana de Ciencia Animal, 10(1), 15-24.
[32] Deluque, J., Reyes, S., Sierra-Labastidas, T. & López, W. (2006). Primeros reportes de familias de macroinvertebrados asociados a macrófitas acuáticas en la ciénaga del Cerro de San Antonio (río Magdalena, Colombia. Revista Intrópica 3,77-86
[33] Rivera-Usme, J.J., Pinilla-Agudelo, G.A. & Rangel-Ch., O. (2013). Ensamblaje de macroinvertebrados acuáticos y su relación con las variables físicas y químicas en el humedal de Jaboque-Colombia. Caldasia, 35(2),389-408.
[34]Molano-Rendon, F., & Morales-Castano, I.T. (2008). Clasificación y hábitats de Gerridae (Heteroptera - Gerromorpha) en Colombia. Acta biológica colombiana 13(2), 41-60.
[35] Bernhardt, E. S., & Palmer, M. A. (2011). The environmental costs of mountaintop mining valley fill operations for aquatic ecosystems of the Central Appalachians. Annals of the New York Academy of Science, 1223, 39-57.
[36] Chará-Serna, A. M., Chará, J., Giraldo, L. P., Zúñiga, M. C., & Allan, J. D. (2015). Understanding the impacts of agriculture on Andean stream ecosystems of Colombia: a causal analysis using aquatic macroinvertebrates as indicators of biological integrity. Freshwater Science, 34, 727-740.
[37] Mosquera,-M, Z y Córdoba-Aragón, K. (2015). Caracterización de la comunidad de macroinvertbrados acuáticos en tres ciénagas de la cuenca media del río Atrato, Chocó, Colombia. Investigación, Biodiversidad y Desarrollo, 34 (1): 22-35. https://www.researchgate.net/publication/321654534.
[38] Mosquera,-M, Z y Sanchez, V, S.(2018). Inventario preliminar de la riqueza genérica y distribución de los coleópteros acuáticos del departamento del chocó, Colombia. U.D.C.A Act. & Div. Cient. 21(1): 155-165 DOI: 10.31910/rudca.v21.n1.2018.674.
[39] Thomaz SM, Dibble ED, Evangelista LR, Higuti J, Bini LM. 2007. Influence of aquatic macrophyte habitat complexity on invertebrate abundance and richness in tropical lagoons. Freshwater Biol. 53 (2): 358-67. doi: 10.1111/j.1365-2427.2007.01898.x
[40] Warfe DM, Barmuta LA, Wotherspoon S. 2008. Quantifying habitat structure: surface convolution and living space for species in complex environments. Oikos. 117 (12): 1764-73. doi: 10.1111/j.1600-0706.2008.16836.x
[41] Dibble ED, Thomaz SM. 2009. Use of fractal dimension to assess habitat complexity and its influence on dominant invertebrates inhabiting tropical and temperate macrophytes. Journal of Freshwater Ecology. 24 (1): 93-102. URL disponible en: http://www.tandfonline.com/doi/abs/10.1080/02705060.2009.9664269.
[42] Álvarez JC, Cuesta. Y, Asprilla M. 2003. Estudio comparativo del bentos y los organismos asociados a macrófitas en un ambiente acuático temporal, Quibdó-Chocó. Revista Institucional Universidad Tecnológica del Chocó. (19): 64-9.