IDENTIFICACIÓN DE MICROORGANISMOS
BIORREMEDIADORES DE SUELOS AGRÍCOLAS DEL NORTE DE ANTIOQUIA PARA
DEGRADACIÓN DEL CLORPIRIFOS
Marta Lucia Hernandez Angel1, Ena
Patricia Lopez2, María Camila Jaramillo
Granda3, Anlly Paola Posada Usuga4
RESUMEN
En
los últimos años se ha encontrado cantidad de agroquímicos acumulados en suelos
agrícolas que los vuelven infértiles, disminuye la calidad de los productos
alimenticios, contaminan el suelo y aguas subterráneas. Un agroquímico
utilizado de manera indiscriminada es el clorpirifos, principal producto de
hidrólisis el 3,5,6-tricloro-2-piridinol.
En
este proyecto se unen dos estrategias de biorremediación para mitigar la
problemática de los agroquímicos, se realiza análisis sobre capacidades de
degradación de microorganismos del suelo contaminado, identificación para
potenciar la facultad de estos, determinación de concentraciones viables para
realizar biodegradación en los suelos agrícolas y disminuir la tasa de
contaminación en el ecosistema y los niveles de intoxicación al ser humano.
El objetivo de esta investigación es analizar y
evidenciar la biodegradación del pesticida clorpirifos a diferentes
concentraciones de microorganismos y solución de nutrientes, con el propósito
de nivelar la sobrecarga de agroquímicos y evitar una mayor contaminación en el
suelo, cultivos y aguas subterráneas.
Palabras
clave: Recuperación
de suelos, contaminación de suelos agrícolas, organismos biorremediadores,
agroquímicos.
Recibido: 6 de septiembre de 2020. Aceptado: 7
de Diciembre de 2020
Received: September 6, 2020.
Accepted: December 7, 2020
IDENTIFICATION OF AGRICULTURAL SOIL BIOREMEDIATION
MICROORGANISMS IN NORTHERN ANTIOQUIA FOR CHLORPYRIFOS DEGRADATION
ABSTRACT
In recent years, a quantity of accumulated
agrochemicals has been found in agricultural soils that make them infertile,
decrease the quality of food products, and contaminate the soil and
groundwater. An agrochemical used indiscriminately is chlorpyrifos, the main
hydrolysis product 3,5,6-trichloro-2-pyridinol.
In this project, two bioremediation strategies are
combined to mitigate the problem of agrochemicals, analyzes are carried out on
the degradation capabilities of microorganisms in contaminated soil,
identification to enhance their ability, determination of viable concentrations
to carry out biodegradation in agricultural soils and decrease the pollution
rate in the ecosystem and the levels of human poisoning.
The objective of this research is to analyze and
demonstrate the biodegradation of the pesticide chlorpyrifos at different
concentrations of microorganisms and nutrient solutions, with the purpose of
leveling the overload of agrochemicals and avoiding further contamination in
the soil, crops and groundwater.
Keywords: Soil
recovery, agricultural soil contamination, bioremediation organisms,
agrochemicals
Cómo citar este artículo: M. Hernandez, E. Lopez, M. Jaramillo,
A. Posada. “Identificación de microorganismos biorremediadores de suelos
agrícolas del norte de Antioquia para degradación del clorpirifos”, Revista
Politécnica, vol.16, no.32 pp.96-110, 2020. DOI:10.33571/rpolitec.v16n32a9
1.
INTRODUCCIÓN
La zona norte de Antioquia se caracteriza por sus
cultivos agrícolas, entre los cuales se destacan papa, fríjol, frutales (uvas,
guayaba, aguacate, mora, lulo, tomate de árbol, uchuva, entre otras) y de
hortalizas (zanahoria, lechuga, espinaca, cilantro, entre otras).
Allí el suelo tiene, en su gran mayoría,
características de suelos orgánicos, su espacio geográfico presenta procesos de
urbanización poco densos lo que lo hace una zona rica en explotación,
principalmente ganadera y agrícola. El clima es frío, presentando una
temperatura media mensual de 14,2ºC, la máxima es de 16ºC y la mínima de 12ºC.
(CMGRD, 2016) Estos suelos agrícolas son constantemente fumigados con
clorpirifos para controlar diversas plagas
El clorpirifos es un insecticida organofosforado, insoluble en agua, con una toxicidad alta,
liposoluble y altamente volátil según condiciones de temperatura. Estas
características facilitan su absorción y permiten una vida media en el suelo de
10-120 días; si se tiene en cuenta que las aspersiones en estos cultivos se
realizan cada 45 días, aproximadamente, se crea una problemática por
bioacumulación.
Como plan de mitigación de este problema se plantean
dos estrategias de biorremediación, la atenuación natural que corresponde a
activar las poblaciones microbianas propias de los suelos que poseen unas
características de adaptación a los plaguicidas y colocarles las condiciones
que permitan que se multipliquen y así poder desarrollar los procesos para una
biorremediación. Con lo que se logra una transformación parcial o total de los
plaguicidas. (Viñas y col, 2001; Nápoles, 2005).
Por otro lado, Viñas y col (2001) y Nápoles (2005)
indican que cuando se realiza una biorremediación dirigida se realizan los
procesos de bioestimulación, que es el proceso con nutrientes que estimulan el
crecimiento de los microorganismos, y la bioaumentación que corresponde a la propagación
previa en laboratorio de los microorganismos identificados como
biorremediadores para agregarlos al suelo e incrementar la población
microbiana y acelerar el proceso natural de descontaminación de los suelos.
Se conoce que las bacterias que presentan una mayor
asociación a la degradación de compuestos organofosforados son: Pseudomonas,
Serratia, Bacillus, Rhodococcus y Streptomyces, Los microorganismos de
carácter fúngico que se presentan un comportamiento de degradación ante los
compuestos organofosforados son: Phanerochaete, Aspergillus, Absidia,
Rhizopus, Penicillium.
Los microorganismos realizan múltiples acciones en
el suelo, al permitir las reacciones que hacen que los nutrientes queden en
estado biodisponible y la interacción con las raíces que aseguren la
disponibilidad y movilidad de estos. Además, son responsables de la estructura,
control de organismos patógenos, degradación de contaminantes diversos en el
suelo”. (González, 2019)
En esta investigación se pretende evidenciar la
biodegradación del pesticida a diferentes concentraciones de microorganismos y
solución de nutrientes adicionadas, con el fin de disminuir la carga de
agroquímicos en los suelos con utilidad agrícola.
2.
MATERIALES Y METODO
2.1 Aislamiento microbiano
Se seleccionó una muestra de suelo que es utilizado
para la actividad agrícola, esta se buscó colocarla en condiciones aisladas en
un recipiente que fue debidamente adecuado para garantizar condiciones normales
de humedad y temperatura (entre 11°C y 22°C humedad 67%), a este se le agregó
83,33 µL de Clorpirifos a una concentración de 200 ppm, que previamente fue
diluida con agua desionizada en un volumen de 50 mL. Esta muestra fue
posteriormente homogenizada, sellada y almacenada durante 30 días.
En el procedimiento que busca el aislamiento de los
microorganismos se preparó una solución de 200 mL con medio mínimo M9 (6 g de
fosfato ácido de sodio hidratado, 3 g de fosfato ácido de potasio, 4 g de
cloruro de amonio, 0,5 g de cloruro de sodio, 0,25 de sulfato de manganeso
heptahidratado, 0,0168 g de cloruro de calcio hidratado) y se utilizaron 83,33
µL de Clorpirifos a 200 ppm, como única fuente de carbono. (Marín L. &
Jaramillo Colorado, 2015).
En tres tubos de ensayo, se preparó la solución y en
cada tubo se colocó 9 mL de la solución previamente preparada con medio mínimo
(M9). A parte, en un erlenmeyer, se depositaron 10 g de suelo y se adicionaron
90 mL de la solución de medio mínimo (M9), con esta última se realizó una
dilución progresiva de concentración hasta un factor de 10-4 para el cultivo de
los microorganismos.
En el proceso de réplica microbiana se preparó un
agar nutritivo, para la incubación en 15 cajas Petri de los microorganismos
obtenidos de los factores de dilución previamente cultivados que se realizó a
37ºC, con una humedad de 65% después de 24 horas. Se escogieron 10 colonias de
microorganismos que habían crecido bajo condiciones de buena propagación y
mostrando alta densidad poblacional, fueron usados especialmente la inoculación
de los microorganismos extraídos de las diluciones 10-3 y 10-4. A estas
colonias de microorganismos se les realizó un repique bajo concentraciones de
Clorpirifos, para verificar la capacidad de ellos a la degradación de este
plaguicida.
2.2 Caracterización de microorganismos
Se realizaron las pruebas de caracterización
correspondientes tanto para bacterias (tinción de Gram, catalasa, oxidasa,
prueba de metabolismo respiratorio, pruebas con medios selectivos) como para
hongos (análisis taxonómicos). La tinción de Gram se realizó para clasificar a
las bacterias en Gram (+) y Gram (-) según la capacidad de retención del
colorante cristal violeta durante la decoloración con alcohol-acetona. Se
realizó la prueba de citocromo oxidasa que sirvió para determinar la presencia
de enzimas oxidasas.
Finalmente, se realizó un análisis taxonómico a un
microorganismo al que se le observó una morfología de hongo, ya que era único
en lo observado y se realizó el montaje por imprenta con cinta translúcida.
Las pruebas con medios selectivos se realizaron sólo
con 5 colonias, que previamente fueron seleccionadas por presentar buen
crecimiento bajo concentraciones de Clorpirifos, en Cetrimide y VRBD.
2.3 Caracterización del suelo.
Conociendo las condiciones y características del
suelo y de las concentraciones de diferentes macronutrientes y micronutrientes
presentes en el mismo, se identificaron los parámetros nutricionales que
requieren los microorganismos para ser estimulados.
Previamente, para realizar esta determinación, se
llevó a cabo el respectivo muestreo de suelo agrícola en la zona norte de
Antioquia, las muestras se tomaron al azar luego de cuartear el terreno y se
tomaron muestras de 10 a 20 cm de profundidad.
Los análisis del suelo se realizaron con las técnicas
y resultados que se presentan a continuación.
Tabla 1. Tabla de pruebas pertinentes para la
caracterización de suelo agrícola.
|
PARÁMETRO
|
TIPO DE PRUEBA
|
|
pH
|
Potenciométrico
agua 1:2
|
|
Porcentaje
de humedad
|
Gravimétrico
|
|
Fósforo
ppm
|
Bray
II modificado
|
|
Porcentaje
de carbono orgánico
|
Digestión
vía húmeda Walkley-black
|
|
Capacidad
de intercambio catiónico meq/100g suelo
|
Extracción
acetato de amonio 1N, método IGAC
|
|
Calcio
cmol/Kg suelo
|
Extracción
acetato de amonio 1N absorción atómica
|
|
Magnesio
cmol/Kg suelo
|
Extracción
acetato de amonio 1N absorción atómica
|
|
Potasio
cmol/Kg suelo
|
Extracción
acetato de amonio 1N absorción atómica
|
|
Zinc
ppm
|
Mehlich
III espectrofotometría de absorción atómica
|
|
Hierro
ppm
|
Mehlich
III espectrofotometría de absorción atómica Mehlich III espectrofotometría de
absorción atómica
|
|
Cobre
ppm
|
Mehlich
III espectrofotometría de absorción atómica
|
|
Manganeso
ppm
|
Mehlich
III espectrofotometría de absorción atómica
|
|
%Arena
2 a 0,05 mm
|
Bouyoucos
|
|
%Arcillas
menor a 0,02mm
|
Bouyoucos
|
|
%Limo
0,05 a 0,002 mm
|
Bouyoucos
|
Hernandez, A. M., (2019). Laboratorio de servicios
tecnológicos del SENA. Análisis de suelos-ECAS, LST-02214.
2.4 Diseño experimental
El diseño experimental, realizado para esta muestra
de suelo agrícola, se realizó con porciones de 1.0 kg de suelo. Este fue
recolectado donde se cultivan hortalizas y es fumigado con plaguicidas entre
los que se encuentran, principalmente, el Clorpirifos. Las muestras para los
ensayos fueron obtenidas de tres puntos de la zona agrícola previamente
establecida, el diseño experimental planteado fue de 23, con tres niveles de
concentración y dos factores que son considerados fundamentales para el
crecimiento de los microorganismos:
·
Nutrientes (con esta solución se busca aplicar la estimulación
para que los microorganismos cuenten con los macro y micronutrientes esenciales
para poder realizar el proceso de biorremediación)
·
Microorganismos (medio líquido con microorganismos para generar
Bioaumentación, obtenidos de los aislamientos previamente realizados de la zona
de cultivo)
Estos factores se usaron en niveles o dosis
diferentes como se presenta en la tabla siguiente y fueron realizados por
réplica.
Tabla 2. Niveles de los factores aplicados en ensayos
pilotos.
|
DOSIS DE MICROORGANISMOS
(Bioaumentación)
|
DOSIS DE NUTRIENTES
(Bioestimulación)
|
|
0 ml
|
0 mL
|
|
2 ml
|
2 mL
|
|
4 ml
|
4 mL
|
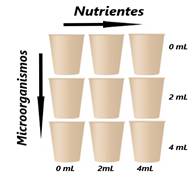
Figura 1: Boceto del diseño experimental.
En primera instancia, se preparó un medio líquido de
microorganismos con las cepas que se tenían previamente seleccionadas de la
siguiente manera: esterilizar el caldo nutritivo en autoclave a una temperatura
de 121ºC durante 20 minutos, dejar reposar hasta que su temperatura disminuya y
agregar las cepas purificadas, triturar las cepas antes de añadirlas en el
caldo nutritivo y luego introducirlas al erlenmeyer que contenga el caldo
nutritivo, finalmente se llevan a un proceso de agitación en un shaker a 37ºC y
240 RPM hasta que esté homogéneo por 24 horas.
La solución de nutrientes realizada fue la
establecida en la tabla 3, por experiencia de los investigadores, a esta se le
agrego melaza como fuente de energía para los microorganismos.
Tabla 3. Micro y macronutrientes usados (Betancur et
al., 2011, 5)
|
MACRONUTRIENTES
|
MICRONUTRIENTES
|
|
271.9 g de Fosfato de potasio
|
6.355 g de Ácido bórico
|
|
213.7 g Nitrato de potasio
|
0.640 g de Sulfato de cobre
|
|
151.2 g Nitrato de sodio
|
16.295 g de Sulfato de manganeso
|
|
247.4 g Sulfato de magnesio
|
6.550 g de sulfato de zinc
|
|
400 g Nitrato de calcio
|
0.985 g de Molibdato de sodio
|
Esta solución nutritiva se prepara en solución A, B,
C, D. la Solución A. Se pesa el fosfato de potasio, Nitrato de potasio, Nitrato
de sodio y sulfato de magnesio; se diluye cada uno de los reactivos en dos
litros de agua, se juntan y se completa a un volumen de 10 litros. La Solución
B. Se pesa Nitrato de calcio, se diluye y lleva a un volumen de 10 litros. Para
la solución C, se pesa el ácido bórico, el sulfato de cobre y el sulfato de
manganeso, cada uno se diluye en agua y finalmente se mezclan y llevan a un
volumen de 1 litro. La solución D. Se pesa el cloruro férrico, el EDTA y se
diluye en 500 ml de agua y finalmente se mezclan y empacan en un frasco opaco
cubierto con papel aluminio. (Betancur et al., 2011).
Para la preparación de la solución para realizar la
bioestimulación para 10 litros se usa: 100 ml de solución A en 1 litro, 2 mL de
solución C en 200 mL, 2 mL de solución D en 200 ml, 100 ml de solución B en 1
litro y 10 g de melaza. (Betancur et al., 2011).
Para las condiciones nutritivas del suelo según
análisis realizado, se ajustan los macro y microelementos del suelo que
garanticen que los microorganismos tengan una bioestimulación con estos
nutrientes y puedan propagarse en cantidades suficientes para bioaumentar la
población. Estos fueron tres semanas muestreados, una vez cada semana y por
medio de cromatografía de gases acoplado a masas, cuantificada la cantidad de
clorpirifos en cada muestra.
3.
RESULTADOS Y DISCUSION
Como resultado de los aislamientos e inoculación
microbiana, se logró observar un crecimiento notorio en la totalidad de las
cajas, como se evidencia en la figura 2.
De este aislamiento se seleccionaron 10 colonias (figura
3). para realizar posteriormente un repique microbiano, pero esta vez bajo
concentraciones de Clorpirifos. Esto con el fin de hacer una purificación de
microorganismos y una obtención de ellos para generar la bioaumentación.
El resultado de uno de ellos fue el crecimiento de un
microorganismo con morfología de hongo. (figura 4).
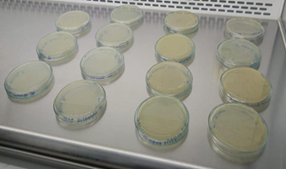
Figura 2: Resultados de los aislamientos microbianos.
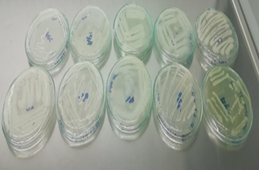
Figura
3: Selección de microorganismos para realizar el
repique microbiano bajo concentraciones de Clorpirifos.

Figura 4: Microorganismo con morfología de
hongo evidenciado en la purificación del microorganismo.
Se
realizó una caracterización macroscópica de 10 colonias que son el resultado de
un aislamiento por diluciones seriadas. Ver resultado en la tabla 4
Tabla
4: Caracterización macroscópica realizada a las 10 colonias de microorganismos
seleccionados previamente.
|
MORFOTIPO
|
CARACTERÍSTICA
|
DILUCIÓN
|
|
CLOR 1
|
Blanca e irregular
|
10-3
|
|
CLOR 2
|
De poco color, irregular-rizoide
|
10-4
|
|
CLOR 3
|
Color opaco, mediana, circular
|
10-4
|
|
CLOR 4
|
Color oscuro, mediana e irregular
|
10-4
|
|
CLOR 5
|
Blanca, pequeña, circular
|
10-4
|
|
CLOR 6
|
Blanca, pequeña, circular
|
10-4
|
|
CLOR 7
|
Blanca, pequeña, circular
|
10-3
|
Del repique
microbiano bajo concentraciones de Clorpirifos se realizó un segundo repique
con el fin de purificar y preservar los microorganismos; a estos morfotipos se
les nombra de la siguiente manera: “CLOR #.2”. Ejemplo, “CLOR 1.2”.
Se realizaron pruebas
de caracterización microscópica, cuatro de ellas no se lograron identificar
debido a su alta carga de microorganismos.
Con
el fin de identificar mejor los microorganismos, y con la ayuda de los
resultados de las pruebas anteriores, se pudieron identificar algunas familias
de bacterias. Los resultados se evidencian en la tabla 5.
Tabla 5: Resultados de pruebas de caracterización
microbiana
|
MORFOTIPO
|
MICROORGANISMO SEGÚN SU FORMA
|
TINCIÓN DE GRAM
|
CATALASA
|
MEDICIÓN CITOCROMO OXIDASA
|
POSIBLE ORIGEN FAMILIAR
BACTERIANO
|
|
CLOR 1.2
|
BACILOS
|
GRAM -
|
POSITIVA
|
POSITIVO
|
PSEUDOMONADACEAE
|
|
CLOR 2.2
|
INDEFINIDO
|
GRAM -
|
NEGATIVA
|
NEGATIVO
|
INDEFINIDO
|
|
CLOR 3.2
|
INDEFINIDO
|
GRAM -
|
POSITIVA
|
POSITIVO
|
INDEFINIDO
|
|
CLOR 4.2
|
INDEFINIDO
|
GRAM -
|
POSITIVA
|
NEGATIVO
|
INDEFINIDO
|
|
CLOR 5.2
|
INDEFINIDO
|
GRAM -
|
NEGATIVA
|
NEGATIVO
|
INDEFINIDO
|
|
CLOR 6.2
|
ESTREPTOCOCOS
|
GRAM +
|
NEGATIVA
|
NEGATIVO
|
STREPTOCOCCACEAE
|
|
CLOR 7.2
|
COCOS
|
GRAM -
|
NEGATIVA
|
NEGATIVO
|
ENTEROBACTERIACEAE
|
|
CLOR 8.2
|
COCOS
|
GRAM -
|
POSITIVA
|
POSITIVO
|
PSEUDOMONADACEAE
|
|
CLOR 9.2
|
COCOS Y BACILOS
|
GRAM -
|
POSITIVA
|
NEGATIVO
|
ENTEROBACTERIACEAE
|
|
CLOR 10.2
|
ESTREPTOCOCOS
|
GRAM +
|
NEGATIVA
|
POSITIVO
|
STREPTOCOCCACEAE
|
En
la prueba de metabolismo respiratorio se evidenció que cinco de los morfotipos
resultaron con características microaerofílicas, lo que indica que son
microorganismos que precisan niveles muy inferiores de oxígeno a los que se
encuentran en la atmósfera de la tierra. Ver resultado en tabla 4
Tabla 6: Resultado de la prueba de metabolismo
respiratorio (propia)
|
MORFOTIPO
|
TIPO DE MICROORGANISMO EN
MEDIO LÍQUIDO
|
|
CLOR 1.2
|
MICROAEROFÍLICO
|
|
CLOR 2.2
|
ANAEROBIA
|
|
CLOR 3.2
|
MICROAEROFÍLICO
|
|
CLOR 4.2
|
MICROAEROFÍLICO
|
|
CLOR 5.2
|
ANAEROBIA
|
|
CLOR 6.2
|
ANAEROBIA
|
|
CLOR 7.2
|
ANAEROBIA
|
|
CLOR 8.2
|
MICROAEROFÍLICO
|
|
CLOR 9.2
|
MICROAEROFÍLICO
|
|
CLOR 10.2
|
ANAEROBIA
|
3.1
Selección de microorganismos:
Como resultado de las pruebas en medios selectivos, se
seleccionaron cinco colonias de bacterias (figura 5), las cuales se sembraron
en Cetrimide, VRBD y manitol.
En el Agar selectivo manitol no se obtuvo crecimiento
en ninguna de las cepas expuestas a dicho medio selectivo
De los aislamientos purificados, la cepa CLOR 8.2
presentó un comportamiento que muestra buen crecimiento, pero cuando fue
cultivado en medios selectivos que permitían establecer el potencial
degradador, no evidenció crecimiento.
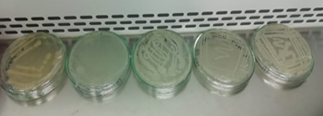
Figura 5: Grupo de bacterias seleccionadas para
pruebas en medios selectivos.
Se evidenció crecimiento en el medio de cultivo
Cetrimide, que es selectivo para pseudomona, en los morfotipos CLOR
3,2, CLOR 6,2 Y CLOR 9,2 y en VRBD, que es selectivo para coliformes,
se evidenció crecimiento en el morfotipo CLOR 3,2 (figura 6).
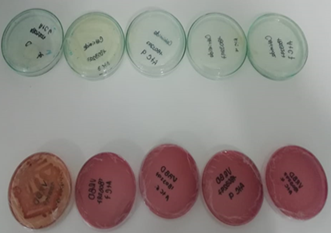
Figura 6: Medios selectivos Cetrimide y VRBD en los
que se observó crecimiento bacteriano.
Se
realizó una caracterización microscópica a las 4 cepas que presentaron
crecimiento en los medios selectivos y se clasificaron en Cocos y Bacilos a
aquellas cepas que crecieron en Agar Cetrimide y, en la cepa que presentó
crecimiento en Agar VRBD, una clasificación de Bacilos.
Otros
análisis realizados fueron pruebas de tinción de Gram, donde se obtuvo un
resultado de Gram (+) para todas las muestras, a excepción del morfotipo CLOR
6,2,. Esto se puede observar en la tabla 7.
Tabla 7: Resultado de pruebas de caracterización
microscópica.
|
MEDIO DE CULTIVO
|
MORFOTIPO
|
MICROORGANISMO SEGÚN SU FORMA
|
TINCIÓN DE GRAM
|
|
Cetrimide
|
Clor 3.2
|
COCOS Y BACILOS
|
GRAM -
|
|
Cetrimide
|
Clor 6.2
|
COCOS Y BACILOS
|
GRAM +
|
|
Cetrimide
|
Clor 9.2
|
COCOS Y BACILOS
|
GRAM -
|
|
VRBD
|
Clor 3.2
|
BACILOS
|
GRAM -
|
En
el análisis taxonómico realizado al microorganismo con morfología de hongo se
logró observar hifas y levaduras, como se evidencia en la morfología básica de
los hongos filamentosos Aspergillus flavus, los cuales habitan en el
heno y el compostaje. (figura 7).
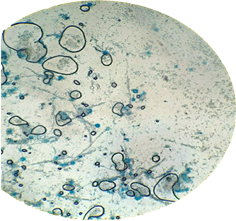
Figura 7: Taxonomía de microorganismo con morfología
de hongo, observado en el lente 100 X
Figura 8: Acercamiento a las hifas y levaduras del
Hongo.
Como resultado de los análisis del suelo, se
obtuvieron los datos presentados en la tabla 8. Estos permitieron identificar
las condiciones de requerimientos de los macro y micronutrientes para asegurar
los procesos de estos microorganismos
En la preparación de la solución de nutrientes, los
materiales más usados son sales solubles en agua que permiten su conservación y
preservación bajo condiciones controladas de luz y temperatura. Con esta se
buscó ajustar los macronutrientes y micronutrientes necesarios para la
biorremediación según diseño experimental, estos ensayos se realizaron por
réplica.
Tabla 8. Resultados de la caracterización del suelo.
|
PARÁMETRO
|
RESULTADO
|
|
pH
|
6,25
|
|
Porcentaje
de humedad
|
14,1
|
|
Fósforo
ppm
|
3,0
|
|
Porcentaje
de carbono orgánico
|
27,7
|
|
Capacidad
de intercambio catiónico meq/100g suelo
|
48,8
|
|
Calcio
cmol/Kg suelo
|
8,7
|
|
Magnesio
cmol/Kg suelo
|
9,5
|
|
Potasio
cmol/Kg suelo
|
0,45
|
|
Zinc
ppm
|
19,9
|
|
Hierro
ppm
|
48,5
|
|
Cobre
ppm
|
4,8
|
|
Manganeso
ppm
|
43,3
|
|
%Arena
2 a 0,05 mm
|
68
|
|
%Arcillas
menor a 0,02mm
|
28
|
|
%Limo
0,05 a 0,002 mm
|
4
|
Hernandez, A. M., (2019). Laboratorio de servicios
tecnológicos del SENA. Análisis de suelos-ECAS, LST-02214.
3.2
Diseño experimental.
En el desarrollo del diseño experimental, se usaron
recipientes plásticos con tapas como se muestra en la figura 9 y en cada
recipiente se colocó el material de suelo de las muestras de zonas de siembra
de hortalizas con las correspondientes porciones de microorganismos en medio
líquido y de nutrientes estos fueron colocados a unas condiciones de
temperatura de 24ºC y un nivel de humedad relativo de 65% en el laboratorio, en
un ambiente favorable para su propagación.
En los ensayos realizados, el nivel de humedad de los
suelos es un factor importante y para evitar que las muestras presentaran altos
nivel de evaporación y se secaran cada dos días se le agregaban 3 ml de agua
destilada asegurando unas condiciones favorables para que los microorganismos
pudieran replicarse y los procesos de los nutrientes fueran aprovechados en los
procesos de estimulación y multiplicación de los microorganismos.

Figura 9. Montaje para ensayo de biorremediación por duplicado
Durante tres semanas, para poder realizar el
seguimiento de las muestras se realizó la medición de Clorpirifos con un
cromatógrafo de gases acoplado a masas, modelo GC 2010, marca Shimadzu y
también, se hicieron algunos ensayos con suelos agrícolas libres de
clorpirifos, que fueron tomadas en la misma finca en zona de cultivo de jardín.
Para la preparación de las muestras para los análisis
de clorpirifos se tomaron 2 g de muestra de suelo se le agregaron 15 mL de una
mezcla 1:1 de hexano: acetona (grado cromatográfico), se agitaron en un shaker
por 12 horas a 240 RPM, posteriormente se dejaron decantar y se separó la parte
orgánica realizando la cuantificación correspondiente. Zapata, M., & María,
G. (2005).
En la gráfica siguiente se muestran para cada uno de
los ensayos del diseño experimental planteado los porcentajes de degradación
del clorpirifos en cada semana, donde N es la cantidad de nutrientes y M
corresponde a la cantidad de microorganismos para cada uno de los ensayos.
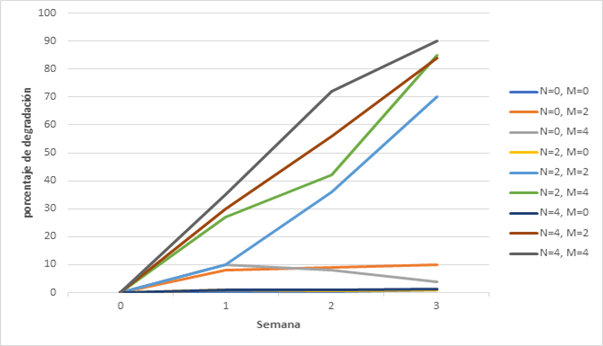
Figura 10. Gráfica de porcentaje de degradación del
clorpirifos en los diferentes ensayos.
De la gráfica se identifica que los ensayos
realizados con nutrientes, aunque fueran en cantidades altas (valores de 2 y 4
ml de nutrientes), pero sin presencia de microorganismos presentaron una
degradación baja indicando que los procesos de bioestimulación que se dan en
este tipo de suelos es baja, indicando que la bioestimulación sola no es
efectiva y además por la presencia de microorganismos que baja como se deduce
de los procesos de propagación de los microorganismos previos a los ensayos.
Para los ensayos con microorganismos sin nutrientes
se identifica que los procesos de reproducción de los microorganismos son muy bajos
y por eso la degradación es muy baja. Indicando que los procesos de
bioaumentación sola tampoco son los más eficientes.
Desde los resultados obtenidos se identifica que el
ensayo con 4 ml de nutrientes y 4 ml de microorganismos presentó los mejores
resultados, es importante resaltar que los microorganismos usados en la
totalidad de ensayos fueron los obtenidos de ese suelo de cultivo de hortalizas
en la zona de San Pedro del departamento de Antioquia y simplemente
multiplicados en el laboratorio para obtenerlos en el medio líquido en
condiciones y cantidades mayores para generar la bioaumentación.
4.
CONCLUSIONES
Tras analizar los resultados de las pruebas de
caracterización, se observó la existencia de microorganismos compatibles con pseudomonas
y Coliformes que utilizaban como su única fuente de carbono el
Clorpirifos.
Se
establece que la combinación de las técnicas de bioestimulación y
bioaumentación fueron más efectivas en los procesos de biorremediación de los
suelos agrícolas de zonas frías.
Para
los ensayos con nutrientes y microorganismos la concentración de
microorganismos y de nutrientes mayor muestra unos resultados muy buenos de
degradación en las tres semanas de los ensayos indicando que este proceso es
eficiente cuando se combinan nutrientes y microorganismos en las cantidades
requeridas.
En los procesos de biorremediación involucrados de
bioaumentación y bioestimulación las condiciones en las que se encuentran los
microorganismos son decisivas para que estos procesos se realicen
satisfactoriamente en tiempos mínimos.
Las cantidades de macro y micronutrientes, el pH
acorde con el tipo de microorganismo, los factores externos como humedad y la
capacidad de intercambio catiónico de los suelos son variables que favorecen y
permiten optimizar la correcta biorremediación microbiana.
Es importante realizar este tipo de ensayos en zonas
de cultivo directamente para identificar los cambios y afectaciones de otras
variables en estos procesos, que no se hayan identificado previamente.
5.
AGRADECIMIENTOS.
Agradecemos al SENA por la motivación para investigar
y por brindar las instalaciones para los análisis de este proyecto. A Laura
María Muñoz Echeverri, Ingeniera Biológica MSc Ciencias Biotecnología, por su
valiosa colaboración y a Venus Verónica Olivares Santamaria, Harold Piedrahíta
Areiza y Dayan Alejandro Herrera Álvarez por su importante participación en la
ejecución de la metodología.
6.
REFERENCIAS BIBLIOGRÁFICAS
[1] Viñas, M.; Sabaté, J.; Grifoll, M.
Solanas, A.M. 2001. Ensayos de tratabilidad en la recuperación de suelos
contaminados por la tecnología de la biorremediación. Residuos. Revista
técnica. 59:78-82
[2] Nápoles, J. 2005. Ensayos de
tratabilidad en suelos contaminados con petróleo. Tesis en opción al título de
Máster en Biotecnología. Mención Ambiental. Universidad de Oriente, Santiago de
Cuba
[3] González, A. (18 de julio de 2019). Microorganismos,
los grandes desconocidos de nuestro suelo. Fertibox.
https://www.fertibox.net/single-post/microbiologia-agricola
[4] Marín L., L. F., & Jaramillo
Colorado, B. E. (2015). Aislamiento de bacterias degradadoras de pesticidas
organofosforados encontrados en suelos y en leche bovina. Revista Chilena de
Nutrición, 42(2), 179–185. https://doi.org/10.4067/S0717-75182015000200010
[5] Quinchía, A., Gómez, F., Palencia Penagos, K.,
& Giraldo Lopera, C. (2006). Evaluación de la de un aislado bacteriano
nativo compatible con Pseudomona sp. al insecticida Lorsban 4 EC. Revista EIA,
(5), 101–108.
[6] Zapata, M. G, Lopera, M. Peñuela, G. Domíngez, M.
(2005, Junio). Evaluación de la degradación del plaguicida clorpirifos en
muestras de suelo utilizando el hongo Phanerochaete chrysosporium. Revista
Facultad de Ingeniería, (33), 58–69.
[7] Barathidasan, K., Reetha, D., Milton, D. J., &
Govindammal, N. S. M. (2014). Biodegradación de clorpirifos por cocultivo de
Cellulomonas fimi y Faneroqueto chrysosporium. Academic journals, 8(9),
961–966.
[8] Anwar, S., Liaquat, F., Khan, Q. M., Khalid, Z.
M., & Iqbal, S. (2009). Biodegradation of chlorpyrifos and its hydrolysis
product 3,5,6-trichloro-2-pyridinol by Bacillus pumilus strain C2A1. Journal of
Hazardous Materials, 168(1), 400–405.
[9] Gómez, S. Gútierrez, D. Hernández, A. Hernández,
C. Losada, M. Mantilla, P. (2008, 9 enero- junio). Factores bióticos y
abióticos que condicionan la biorremediación por Pseudomonas en suelos
contaminados por hidrocarburos. NOVA. https://hemeroteca.unad.edu.co/index.php/nova/article/view/398/1158.
[10] CMGRD. (2016). Consejo Municipal para la Gestión
del Riesgo de Desastres Municipio San Vicente del Caguán. Gobernacion de
Caqueta, 139. https://caqueta.micolombiadigital.gov.co/sites/caqueta/content/files/000623/31140_pmgrd-san-vicente-del-caguan-final.pdf.









