1. INTRODUCCIÓN
Escobedia grandiflora (L.F) Kuntze (Fam: Orobanchaceae) es una planta nativa del continente americano, de naturaleza hemiparásita de las raíces y fue usada como colorante de alimentos y con fines medicinales, desde tiempos precolombinos hasta finales de los años 70 [1], [2]. Sin embargo, a pesar de los registros históricos sobre la abundancia de E. grandiflora en el pasado [3], actualmente su presencia se ha reducido de forma considerable, de modo que las poblaciones silvestres se restringen a terrenos escarpados de difícil acceso, pedregosos o bordes de carretera [4]; como consecuencia el uso y conocimiento sobre la especie se ha ido perdiendo. Siendo uno de los aspectos críticos de la propagación de E. grandiflora la obtención de plántulas desde semilla [1], actualmente en la literatura solo se registran tres estudios relacionados con su propagación: En el primero se realizó propagación in vitro a partir de entrenudos [5], en el cual los autores evaluaron el uso de las hormonas benzilaminopurina (BAP) 0,5 mg/l y ácido indolbutírico (AIB) 1 mg/l, agregadas al medio Murashige y Skoog - MS, para obtener nuevas plantas. El segundo estudio [1] se evaluó la germinación de semillas bajo dos condiciones de luz y temperatura, sin hormonas adicionales, encontrando que a diferencia de otras especies de la familia Orobanchaceae, las semillas de E. grandiflora no requieren del hospedero para germinar y la temperatura optima fue de 25°C. El tercer estudio [6] evaluó la desinfección de las semillas de azafrán de raíz con etanol al 70% durante dos minutos, posteriormente se sometieron a hipoclorito de sodio al 1% durante cinco, diez y 15 minutos, dando como mejor resultado los tratamientos con mayor tiempo en hipoclorito.
Se ha propuesto, un método para la conservación de especies en peligro, es su propagación por medio del cultivo de tejidos o el mantenimiento de colecciones in vitro, con el fin de disminuir la presión sobre las poblaciones naturales [7]; estas técnicas de micropropagación han sido de gran importancia para algunas especies amenazadas, de difícil obtención por técnicas comunes [8]. Donde, en algunas especies de la familia Orobanchaceae, se han realizado estudios de micropropagación, en los cuales se evalúan el efecto estimulante de sustancias liberadas por raíces de los hospederos sobre la germinación de semillas de la planta parásita [9], [10], [11], [12]. Aunque, la relación de parasito-hospedero en E. grandiflora no ha sido suficientemente estudiada; sin embargo, Cardona [13] describió que, a los 22 días de la emergencia de la raíz, el haustorio alcanza con éxito al hospedero. En la especie holoparasita Aegineta indica L. la formación de su estructura parasitaria es inducida naturalmente por la raíz del hospedero (Poaceae: Miscanthus sp.) [9], y en cultivo de tejidos, logró ser promovida por la adición de glucosa y sacarosa, y el crecimiento longitudinal de las mismas por una citoquinina [14]. La germinación in vitro de Cistanche sp. y Orobanche aegyptiaca (Pers.) Pomel, fue inducida con leche de coco e hidrolizado de caseína, sustituyendo el estímulo de exudados producidos por el hospedero para lograr su germinación [10]; mientras que en la especie Castilleja tenuiflora Benth. se encontró que el mejor método para la inducción de brotes consistía en enriquecer el medio (MS) con BAP y ácido naftalenacético (ANA) [11]. Adicionalmente, para el género Phelipanche se han realizado estudios in vitro de manipulación genética, con el fin de aislar genes involucrados en la relación hospedero-parásito; en un esfuerzo por controlar la presencia de plantas parasitas en los cultivos de importancia alimenticia como papa, tomate, lechuga, entre otros [12].
Es de resaltar que las fitohormonas tienen funciones imprescindibles en las plantas, donde el ácido indol-acético (AIA) es una de las auxinas biológicamente más activas [15], relacionada con procesos de división del cambium vascular y la formación de raíces laterales [16], [17], la germinación de semillas [18], elongación de tallos, inducción de la floración, algunos tropismos y promoción de la dominancia apical [17]. Mientras que el AG3 perteneciente al grupo de las giberelinas, participa en funciones como la germinación de semillas, elongamiento y engrosamiento del tallo, expansión de las hojas, alargamiento de la raíz, floración, partenocarpia y liberación de enzimas hidrolíticas en algunos tejidos [19]. Sin embargo, el efecto de las hormonas puede ser variable, dependiendo de la concentración en que se encuentre y de la interacción con otras hormonas [15].
Los objetivos del presente trabajo fueron: determinar la mejor desinfección de la semilla de E. grandiflora por tiempo de inmersión en hipoclorito de sodio, evaluar la germinación de semillas in vitro con aplicación de las hormonas ácido indolacético - AIA (0, 1, 1,5 y 2 mg/l) y ácido giberílico - AG3 (0 y 0,5 mg/l), y finalmente, evaluar dos gelificantes y tres concentraciones de AIA en el crecimiento de las plántulas in vitro. Todo ello, en el marco de una estrategia para contribuir con la conservación de la especie.
2. MATERIALES Y METODO
Este trabajo se realizó en el Laboratorio de Biotecnología Vegetal del Politécnico Colombiano Jaime Isaza Cadavid, ubicado en el Centro de Laboratorios y Experimentación, Sede Bello (Antioquia - Colombia), a 1.420 m.s.n.m., con una temperatura ambiente promedio de 25°C.
Las semillas fueron recolectadas de plantas ubicadas en el municipio de Concepción (Antioquia – Colombia), (coordenadas 6º53’52’’N, 75º11’0,35’’ W). Las semillas fueron extraídas de las cápsulas y se visualizaron en el estereoscopio para seleccionar aquellas sin daño mecánico.
Desinfección y germinación de semilla
Las semillas de azafrán de raíz se sumergieron en etanol al 70% durante 10 segundos, posteriormente se introdujeron en hipoclorito de sodio al 0.4 %, variando su tiempo de inmersión (120, 90, 60 y 30 segundos). Después antes de la siembra, las semillas se lavaron con agua destilada estéril y se hidrataron durante 12 horas. Para determinar el mejor tratamiento de desinfección, se evaluó la germinación y el porcentaje de contaminación durante tres semanas, donde se emplearon 180 semillas en total, distribuidas de a 45 semillas en cada uno de los cuatro tratamientos (tiempo de inmersión en hipoclorito, mencionado anteriormente. Las variables contaminación (C) y germinación (G) se determinaron según las siguientes expresiones [20]:

Dónde C = contaminación, G = germinación, GM = germinación media, Si = semillas germinadas, x = días
En la germinación se evaluó el efecto de la aplicación de dos hormonas, en ocho tratamientos: AG3 en concentración 0 y 0,5 mg/l y AIA en concentraciones de 0, 1, 1,5 y 2 mg/l. Y esta se registró desde el momento en que la coloración verde del embrión se produjo, como señal de la activación de procesos metabólicos previos a la emergencia de la radícula.
Desarrollo de plántulas
Las semillas de azafrán se sembraron en medio MS [21] suplementado con sacarosa (30 g/L), y los gelificantes Phytagel TM (marca Sigma) en concentraciones 1,4, 1,9 y 2,4 g/L, y Bactoagar Difco ® (marca Becton Dickinson) en concentraciones 6,0, 6,5 y 7,0 g/L. Posteriormente se adicionaron dos hormonas de crecimiento: AG3 en concentración única de 0,5 mg/l a todos los tratamientos, excepto en el control. En el ensayo de germinación de E. grandiflora se encontró que la adición de AG3 permitía un mejor desarrollo de las plántulas, por lo cual se decidió incorporarlo en la concentración mencionada (0,5 mg/l) en todos los tratamientos. El AIA se evaluó en las concentraciones de 0, 1, 1,5 y 2 mg/l, dando un total de 24 tratamientos, con 90 semillas por tratamiento (30 frascos, tres semillas por frasco). Estos frascos se llevaron al cuarto de crecimiento, bajo condiciones de luz blanca proveniente de lámparas fluorescentes de 40 w. en un ciclo de 12 horas luz y 12 horas oscuridad, tomando los datos durante seis semanas sobre las variables: longitud total de la planta y longitud de la raíz.
Análisis estadístico
Para responder cada objetivo se hicieron diseños experimentales completamente aleatorios, y con los datos obtenidos se realizaron análisis de varianza, empelando el programa R Software. Así, para los tiempos de desinfección en hipoclorito (objetivo 1) se hizo un Anova de una vía, y para la germinación de las semillas de azafrán de raíz (AIA y AG3) (objetivo 2) se hizo un Anova de dos vías (AIA y AG3). Los datos del desarrollo de las plántulas de azafrán de raíz (objetivo 3) fueron evaluados a través de un Anova de dos vías (gelificante (Phytagel y Bactoagar) y la hormona AIA. Las diferencias entre tratamientos se determinaron con la prueba de contraste Tukey.
3. RESULTADOS
Se encontró que las semillas sumergidas durante 120, 90 y 30 segundos en hipoclorito de sodio, no presentaron contaminación. Mientras que las semillas sumergidas durante 60 segundos se contaminaron en un 40%, lo cual puede atribuirse al manejo inadecuado de los explantes en el momento de la siembra, sin relación con la variable evaluada. Los mayores porcentajes de germinación se tuvieron con semillas sumergidas en hipoclorito de sodio durante 120 y 90 segundos (p=0,005), con valores de 96% y 100% respectivamente, mientras que los tratamientos de inmersión en hipoclorito durante 30 y 60 segundos (82% y 73% respectivamente).
Efecto de AIA y AG3 en la germinación
En el porcentaje de germinación se presentaron diferencias muy significativas (p=0,00) (Figura 1). De modo que, en la segunda semana, se logró un porcentaje de germinación superior al 90% en los tratamientos sin hormonas y cuando se tenía AG3 (independiente de la concentración de AIA). En contraste, las semillas de los tratamientos sin AG3, en la segunda semana presentaron un porcentaje de germinación entre 60 y 80%, y alcanzaron los mayores valores de germinación en la semana tres. De igual modo, en los tratamientos control (sin hormonas) y con presencia de AG3, independiente de la concentración de AIA, presentaron una mayor germinación media en la segunda semana y una menor variación de los datos promedios (Figura 1), al compararse con los tratamientos que no tenían AG3.
Estos resultados sugieren que el mejor tratamiento para la germinación de semillas de E. grandiflora fue el control (Figura 1), ya que alcanza un porcentaje de germinación de las semillas de más de un 90% en la segunda semana, al igual que el AG3, por lo cual no sería necesario adicionar esta hormona.
Efecto del gelificante y AIA en el desarrollo de plántulas
En este trabajo se encontró que es posible obtener plántulas in vitro de azafrán de raíz (Figura 2). Donde el desarrollo de las plántulas fue afectado por el tipo de gelificante y la aplicación de AIA.
En este estudio, el gelificante Phytagel fue mejor para el crecimiento de las plántulas de E. grandiflora (p=0,00), aunque hubo una alta variación de los datos, la mayor longitud de la planta completa se logró con este gelificante en concentración de 1,9 g/l, en interacción con la concentración de AIA a 1.0 mg/l. (Tabla 1, Figura 3a). En contraste, la longitud de la raíz fue mejor en el gelificante Phytagel en concentración de 2.4 g/l y sin aplicación de hormona AIA (Tabla 1, Figura 3b).
4. DISCUSIÓN
Las semillas de E. grandiflora presentaron un alto porcentaje de germinación, en el cual no fue necesario el hospedero ni la aplicación de hormonas para germinar, adicionalmente, la desinfección de semillas adecuada y sin daño al embrión consistió en la inmersión en etanol al 70% durante 10 segundos e hipoclorito al 0,4% durante 90 segundos. Este resultado fue mejor que el obtenido por Macedo et al. [6] con E. grandiflora, quienes tuvieron un porcentaje de contaminación mayor, empleando el método de etanol al 70% durante dos minutos y posteriormente una inmersión de las semillas en hipoclorito de sodio en concentración de 1% durante 5, 10 y 15 minutos. Morales et al. [11] utilizaron como desinfectante de semillas de C. teuniflora etanol al 70% durante (0, 30 y 60 segundos), mientras las semillas aún estaban dentro de la capsula cerrada. En este trabajo esto no fue posible la desinfección a nivel de estos frutos, debido a que las cápsulas de E. grandiflora presentaban daño por insectos.
Varios autores han registrado que la hormona AG3 participa de forma importante en el proceso de germinación de las semillas y en la interrupción de la latencia [22], [23], aquí se encontró que, si bien la aplicación AG3 es importante, su adición no representa una mejora con respecto al control en la germinación de E. grandiflora, lo cual se debe posiblemente a que las semillas no presentaron latencia. Por otro lado, la adición de AIA no tuvo una mejora representativa en las plantas de azafrán de raíz; siendo esto posible gracias a la complejidad de la acción de las auxinas como AIA, al participar en muchos procesos biológicos de las plantas (la división celular, el alargamiento en los tallos y la formación del embrión de la semilla, formación de hojas, flores y raíces, entre otras) [15], [23]. Y, aunque se considera que, en conjunto estas dos hormonas actúan de manera determinante en el crecimiento de las plantas [15], [24]; con los resultados de este estudio determinó que el desarrollo de las plántulas sin hormonas es mejor que con la adicción de AIA y AG3. De hecho, las plantas producen naturalmente las hormonas que requieren para su crecimiento, y este proceso puede inhibirse cuando hay mayor concentración del AIA de lo requerido por la planta [23]; es posible que la fuente de hormonas natural sea suficiente para el buen desarrollo de las vitroplantas de azafrán de raíz.
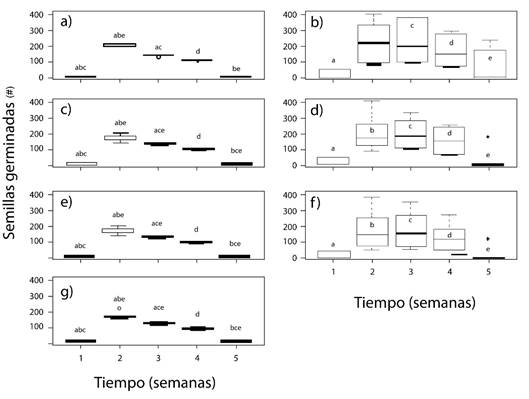
Figura 1. Germinación media de las semillas de E. grandiflora con AIA y AG3. a) control (sin hormonas), b) AIA 1 mg/l y AG3 0 mg/l, c) AIA 1 mg/l y AG3 0.5 mg/l d) AIA 1.5 mg/l y AG3 0 mg/l, e) AIA 1.5 mg/l y AG3 0.5 mg/l, f) AIA 2 mg/l y AG3 0 mg/l y g) AIA 2 mg/l y AG3 0.5 mg/l. Letras diferentes corresponden a diferencias significativas.

Figura 2. Semilla y desarrollo de plántula de E. grandiflora. (a) Semilla en la segunda semana, (b) plántula con cotiledones en la tercera semana, (c) plántula con primer par de hojas en la cuarta semana, (d) plántula con dos pares de hojas en la quinta semana y, (e) plántula con tres pares de hojas en la sexta semana.
Tabla 1 Efecto del gelificante y concentración de AIA en plántulas de E. grandiflora
|
Tratamiento |
Grados de libertad |
Valor F |
P (F) |
|
|
Longitud de la planta |
Gelificante |
5 |
8,613 |
0.00 |
|
AIA |
3 |
36,003 |
0.00 |
|
|
Residuales |
231 |
|||
|
Longitud de la raíz |
Gelificante |
5 |
7.785 |
0.00 |
|
AIA |
3 |
126.868 |
0.00 |
|
|
Residuales |
231 |
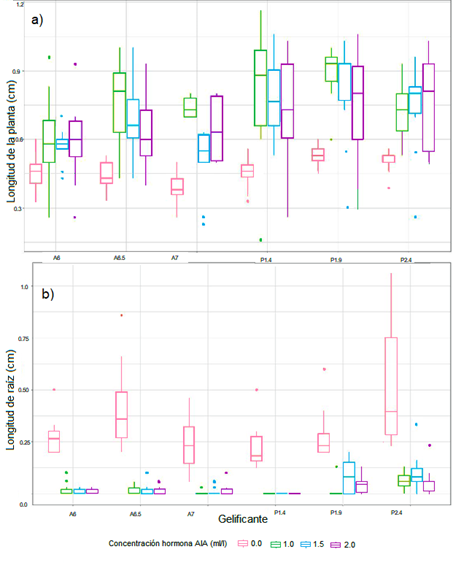
Figura 3. Efecto de dos gelificantes y cuatro concentraciones de AIA en el desarrollo de plántulas de E. grandiflora. a) longitud de la planta, b) longitud de la raíz En el eje X: A – gelificante Bactoagar, P – gelificante Phytagel.
E. grandiflora presenta un crecimiento lento en la etapa de plántula, concentrando las reservas de alimento para el desarrollo de las raíces [13], ya que esto es fundamental para adherirse a un hospedero, del cual depende parcialmente para su nutrición. Es posible que esta característica haya determinado que, en la evaluación de la longitud de raíz, se encuentra que el tratamiento sin hormonas permite su mejor desarrollo (Figura 3b), que cuando se aplica AIA en diferentes concentraciones (en presencia de AG3 al 0.5 g/l). Este efecto se modifica cuando se evalúa la planta completa, mostrando que el AIA favorece el crecimiento del vástago; sin embargo, la duración del estudio no permitió evaluar a mediano plazo que hubiese sido mejor para la sobrevivencia de las plantas.
Además, la longitud de la raíz y de la planta completa, fue mejor en el gelificante Phytagel (Tabla 1), posiblemente debido a que este polisacárido tiene pocas impurezas, permite que el pH del medio sea estable y se mantiene en el tiempo [25]. Algunos autores indican que el Phytagel proporciona claridad en los geles, permitiendo visualizar mejor el proceso de crecimiento de la planta y la contaminación temprana [26], [27], además, es de bajo costo [28].
El reto que queda pendiente de resolver con la propagación in vitro de E. grandiflora es el proceso de aclimatación exitosa, que incluye el establecimiento de un hospedero, considerando que es una planta hemiparásita y que recientemente se describió el periodo de formación de haustorios a los 22 días después de la germinación y de primeras hojas definitivas a los 43 días [13].
5. CONCLUSIONES
Este trabajo demuestra que es posible la propagación in vitro de azafrán de raíz a partir de semilla sexual sin adición de hormonas. Constituyendo este una gran oportunidad de propagación de la especie, debido a que las capsulas pueden contener hasta 300 semillas y el porcentaje de germinación fue mayor al 90%. De acuerdo con los resultados obtenidos, el mejor método para la desinfección de las semillas es su inmersión en hipoclorito de sodio al 0,4% de concentración, durante 90 segundos, lo cual permitió una germinación del 100% sin contaminación.
En este trabajo se encontró que la obtención de plántulas de azafrán de raíz in vitro a partir de semilla sexual es posible, aunque es necesario continuar evaluando el efecto de las hormonas que se adicionen e incluso evaluar otras hormonas. En las hormonas y dosis evaluadas se concluye que, para obtener una mayor germinación, el tratamiento sin hormonas, y aquellos con adición de AG3 (0,5 mg/l) fueron mejores que los tratamientos que solo contenían AIA. Así mismo, se determinó que el Phytagel es el mejor gelificante del medio de cultivo, con respecto al Bactoagar, para la propagación in vitro.
El azafrán de raíz es una planta silvestre que, sí se logra una propagación exitosa y su cultivo, traería beneficios para las comunidades rurales y urbanas, debido a su potencial medicinal, industrial y culinario. Por ello, es necesario fomentar su protección, aprovechamiento responsable y realizar estudios para evaluar su efecto sobre otras especies vegetales con las que interactúa, por ser una planta hemiparasita.
6. AGRADECIMIENTOS
Al Politécnico Colombiano Jaime Isaza Cadavid y a ISAGEN por la financiación de este trabajo. A E. Cardona por abrirnos las puertas del mundo de las plantas parasitas, a Y Salazar por explicarnos el manejo de los equipos, A Martínez y MC Vargas por aportar sus conocimientos estadísticos, a C Gamboa por facilitarnos semilla de azafrán de raíz, a L Lara por la edición de las figuras, al grupo de investigación SAT por facilitar sus laboratorios.
7. REFERENCIAS BIBLIOGRÁFICAS
[1] Cardona, E. y Muriel, S.B. Seed germination and plant development in E. grandiflora (Orobanchaceae): evidence of oblígate hemiparasitism?. Acta Biológica Colombiana, 20, 133-140, 2015. http://dx.doi.org/10.15446/abc.v20n2.43776
[2] Gómez, A., Arias, E., Cardona, E., Muriel, S.B. Sabor y color de tres especies condimentarias en Colombia. p.518-536. En: El pasado del futuro alimentario. Instituto de investigaciones Dr. José María Luis Mora, México, p.518 – 536, 2018.
[3] Daniel, H. Plantas utilizadas en los laboratorios de farmacia. Revista Universidad Pontificia Bolivariana, 24(87), 426-494, 1960.
[4] Muriel, S.B., Cardona, E., Arias, E., Gómez, C. 2015. Indagaciones acerca del azafrán de raíz (Escobedia grandiflora (Lf) Kuntze en Antioquia-Colombia: una especie olvidada. Etnobiología, 13(2), 85-93, 2015.
[5] Castro D, Arredondo JA, Jaramillo DA. 2012. Propagación in vitro del azafrán de raíz (E. grandiflora L.f.) Kuntze. Revista UCO, 33, 23-39, 2012.
[6] Macedo, K.T., Kazue, F.M., Tamaki, V. Desinfestação de sementes de E. grandiflora (L. f.) Kuntze no estabelecimento in vitro. Reunião anual do instituto de botánica. Reunión llevada a cabo en São Paulo, Brasil, 2013.
[7] Domínguez, J.A. Biodiversidad y protección de especies y hábitats. Boletín de la SEA, 17, 11-14, 1997.
[8] Fay, M. y Clemente, M. Aplicación de las técnicas de cultivo de tejidos en la propagación y conservación de especies amenazadas. Monografías del Real Jardín Botánico de Córdoba, 5, 43-50, 1997.
[9] Kato, Y. y Hisano, K. In vitro culture of a root parasite, Aeginetia indica L. I. General survey. The botanical magazine Shokubutsu-gaku-zasshi, 96, 203-209, 1983. https://doi.org/10.1007/BF02499001
[10] Deeks S, Shaomoun, S.F., Punja, Z.K. Tissue culture of parasitic flowering plants: Methods and applications in agriculture and forestry. In vitro Cellular & Developmental Biology-Plant, 35(6), 369-381, 1999. https://doi.org/10.1007/s11627-999-0050-9
[11] Salcedo, G., Rosas, G., Nabor, N., Bermudez, K., López, A., Trejo, G. Propagation and conservation of Castilleja tenuiflora Benth. (“Hierba del cáncer”) through in vitro culture. Polibotánica, 28, 119-137, 2009.
[12] Kullačová, D., Matúšová, R. Establishment of Phelipanche ramosa tissue culture and effect of kanamycin on culture growth. Journal of Microbiology Biotechnology and Food Science, 4, 63-65, 2015. https://doi.org/10.15414/jmbfs.2015.4.special2.63-65
[13] Cardona, E. Escobedia grandiflora (Lf) Kuntze (Orobanchaceae): estrutura e ultraestrutura seminal e pós-seminal no parasitismo com Pennisetum purpureum. [Tesis de maestría]. [Florianopolis (Brasil)]: Universidade Federal de Santa Catarina, 2017.
[14] Kato, Y., Inoue, T., Onishi, Y. In vitro culture of a root parasite, Aeginetia indica L. ll. The plane of cell division in the tendril. Plant and Cell Physiology, 25(6), 981-987, 1984. https://doi.org/10.1093/oxfordjournals.pcp.a076814
[15] Garay, A., de la Paz, M., García, B., Álvarez, E.R., Gutiérrez, C. La Homeostasis de las Auxinas y su Importancia en el Desarrollo de Arabidopsis thaliana. Revista de Educación Bioquímica, 33(1), 13-22, 2014.
[16] Srivastava, L.M. Plant growth and development Hormones and the environment. Oxford: Editorial Academic Press, 2002.
[17] McSteen, P., Zhao, Y. Plant hormones and signaling: common themes and new developments. Developmental Cell, 14(4), 467-473, 2008. https://doi.org/10.1016/j.devcel.2008.03.013
[18] Tamas, I.A., Davies, P.J. Dynamics and control of phloem loading of indole 3 acetic acid in seedling cotyledons of Ricinus communis. Journal of Experimental Botany, 67, 4755-4765, 2016. https://doi.org/10.1093/jxb/erw255
[19] Ueguchi-Tanaka, M., Nakajima, M., Motoyuki, A., Matsuoka, M. Gibberellin receptor and its role in gibberellin signaling in plants. Plant Biology, 58, 183-198, 2007. https://doi.org/10.1146/annurev.arplant.58.032806.103830
[20] Kader, M.A. comparison of seed germination calculation formulae and the associated interpretation of resulting data. Journal and Proceeding of the Royal Society of New South Wales, 138, 65-75, 2005.
[21] Murashige, T. y Skoog, F.M. A revised médium for rapid growth and bioassays with tobacco tissue culture. Physiology Plant, 15, 473-479, 1962.
[22] Bewley, J.D. Seed germination and dormancy. The Plant Cell, 9(7), 1055-66, 1997. https://doi.org/10.1105/tpc.9.7.1055
[23] Taiz, L. y Zeiger, E. Plant Physiology. 3 ed. Sunderland Editorial Sinauer associates, 2002.
[24] Rivero, A., Medina, E., Zavaleta, A. Efecto sinérgico del ácido indolacético, ácido giberélico y 6-bencilaminopurina en la propagación in vitro de “papaya” Carica papaya L. (Caricaceae). ARNALDOA, 23(2), 577-586, 2016.
[25] Martin, D.A., Cárdenas, O., Constantino, J. Sustancias utilizadas como agente gelificante alternativas al agar en medios de cultivo para propagación in vitro. Revista de Investigación Agraria y Ambiental, 3(2), 9-62, 2012. https://doi.org/10.22490/21456453.972
[26] Pedroza, J. y Caballero, M. Evaluación del efecto del medio MS y la temperatura en el desarrollo de propágulos de Marchantia polymorpha L. (Marchantiaceae) bajo condiciones in vitro y ex vitro. Revista Colombiana de Biotecnología, 11(2), 85-104, 2009. https://doi.org/10.15446/rev.colomb.biote
[27] Kaçar, Y., Biçen, B., Varol, I., Mendi, Y., Serçe, S. y Çetiner, S. Gelling agents and culture vessels affect in vitro multiplication of banana plantlets. Genetics and Molecular Research, 9(1), 416-424, 2010. https://doi.org/10.4238/vol9-1gmr744
[28] Loaiza, C. Análisis fisiológico del efecto de tres marcas de agar y Gelrite en la germinación y desarrollo in vitro de plántulas de Echinocactus platyacanthus Link et Otto (Cactaceae) [tesis de pregrado]. [Hidalgo (México)]: Universidad Autónoma del Estado de Hidalgo, 2008: