EFECTOS ASOCIADOS AL CAMBIO
DEL CAUCE DEL RÍO SAN LORENZO, EL CARMEN DE VIBORAL-ANTIOQUIA
Jorge
Wilson Naranjo Cardona 1, Yimmy Montoya-Moreno 2
1Magister en Ciencias Naturales y Matemática
Universidad Pontificia Bolivariana, Medellín, Colombia, e-mail:
wjnaranjo@gmail.com.
2Doctor en Ingeniería, Investigador Grupo Geolimna,
Universidad de Antioquia, docente Universidad Pontificia Bolivariana e-mail: yimmymontoya3@hotmail.com.
RESUMEN
El
objeto de investigación en este proyecto giró en torno a los cambios que sufre
el cauce de un río al ser modificado su curso. Para ello se llevó a cabo un
trabajo de muestreo en la cuenca hidrográfica del río San Lorenzo, ubicado en
el Municipio de El Carmen de Viboral, Oriente Antioqueño, teniendo en cuenta
variables fisicoquímicas y bioindicadores como los macroinvertebrados
bentónicos. Se corroboró que la desviación y/o cambio del cauce del río San
Lorenzo, ha provocado modificaciones en sus características fisicoquímicas y
biológicas, evidenciadas en la disminución de la concentración y saturación del
oxígeno disuelto, aumento del pH (debido al incremento en la cobertura del
perifiton y la fotosíntesis que este genera) y la temperatura del agua (el agua
casi no presenta flujo, por lo que se incrementa su energía cinética). Respecto
a los macroinvertebrados acuáticos se registró una reducción fuerte de la
riqueza y diversidad respecto al cauce normal del río. También se encontró un
cambio en la estructura de la comunidad de los macroinvertebrados menos
resistentes a la contaminación por otros más tolerantes, pérdida de
biodiversidad acuática y un incremento en la concentración de fósforo en el
agua derivado de los desechos de una truchera.
Palabras clave: Desvío
de cauce, disturbio, macroinvertebrados acuáticos, enriquecimiento de fósforo.
Recibido:
31 de Marzo de 2020. Aceptado: 16 de Diciembre de 2020
EFFECTS ASSOCIATED BY THE CHANGE OF CAUCE
RÍO SAN LORENZO, CARMEN DE VIBORAL ANTIOQUIA
ABSTRACT
Abstract The object of investigation in this project revolves
around the changes that the riverbed undergoes when its course is modified. For
this, a sampling work will be carried out in the San Lorenzo river basin,
located in the Municipality of El Carmen de Viboral, Oriente Antioqueño, taking
into account physicochemical variables and bioindicators such as benthic
macroinvertebrates. It was confirmed that the deviation and / or change of the
San Lorenzo river channel has caused changes in its physicochemical and biological
characteristics, evidenced in the decrease in the concentration and saturation
of dissolved oxygen, increase in pH (due to the increase in the coverage of the
periphery and the photosynthesis that this generates) and the temperature of
the water (the water almost does not present flow, reason why its kinetic
energy is increased). Regarding aquatic macroinvertebrates, there was a strong
reduction in wealth and diversity compared to the normal riverbed. A change was
also found in the community structure of macroinvertebrates less resistant to
contamination by more tolerant ones, loss of aquatic
biodiversity and an increase in the concentration of phosphorous in the water
derived from the waste of a trout.
Keywords: Channel diversion, disturbance,
aquatic macroinvertebrates. phosphorus enrichment.
Cómo citar este artículo: J. Naranjo, Y. Montoya. “Efectos
asociados al cambio del cauce del río San Lorenzo, el Carmen de Viboral-Antioquia”,
Revista Politécnica, vol.16, no.32 pp.112-128, 2020.
DOI:10.33571/rpolitec.v16n32a11
1.
INTRODUCCIÓN
El agua es esencial para el
mantenimiento de todos los procesos biológicos, la calidad de vida de una
sociedad y el sostenimiento de las actividades económicas. La calidad del agua
está definida por su composición química y por sus características físicas,
adquiridas a través de procesos naturales y antropogénicos que limitan o
perjudican su uso. Este es evaluado al comparar los valores que asumen los
parámetros indicadores con estándares y criterios establecidos. La variación
espacio temporal de la calidad se modifica por el influjo de múltiples
actividades socioeconómicas y naturales, y la intensidad de esta variación es
determinada por las características propias de estas dinámicas [1].
Es claro que durante el último siglo
se han llevado a cabo numerosas actuaciones con fines de regulación hidrológica
(embalses), de restauración hidrológico-forestal (repoblaciones, diques de
retención), de protección contra inundaciones (motas, malecones, encauzamientos),
de explotación de recursos (canteras), etcétera, que han alterado profundamente
aguas abajo el balance de agua y sedimento y, con ello, la morfología de los
cauces [2]. En definitiva, toda una serie de perturbaciones introducidas por el
hombre en un sistema ambiental de frágil equilibrio como es el fluvial.[3] refiere que la construcción de
represas, bien sea para proyectos hidroeléctricos, suministro de agua o control
de inundaciones, ha causado impactos en el campo de la biología y ecología de
los mismos ríos (pérdida de hábitat, nichos, freno a la migración de peces y
otros).
Las alteraciones morfológicas son
alteraciones de la forma del río. Suponen la modificación total o parcial de
los sistemas fluviales. Entrarían aquí actuaciones como defensas, dragados,
extracciones de áridos, rectificaciones de cauce, canalizaciones, urbanización
y construcción de estructuras en las márgenes [4]. Dichas modificaciones y
actividades, “generan efectos graves en la disponibilidad espacio – temporal de
la oferta hídrica, lo que deteriora las condiciones fisicoquímicas y biológicas
del agua” [5].
Estudios realizados en diferentes
ríos, evidencian impactos a partir de la modificación en la morfología del
cauce por causas de tipo antrópico [1], [2], [5]. Dichos impactos se ven
reflejados en los componentes fisicoquímicos y biológicos del agua que son a su
vez un indicador importante. [2] infieren que los cambios originados aguas
arriba influyen aguas abajo con un retardo temporal causa efecto, especialmente
en los tramos medio e inferior de los cursos fluviales.
En la actualidad, comunidades
biológicas como las de macroinvertebrados bentónicos, han sido incluidas como
indicadoras de las condiciones ambientales de ecosistemas acuáticos, ya que su
prevalencia en el ambiente en el que viven, refleja niveles de presión
antrópica sobre los mismos. [3], [6], [7]. Para el ecólogo, un ecosistema acuático es un
sistema funcional en el cual hay un intercambio cíclico de materia y energía
entre los organismos vivos y el ambiente abiótico. Por lo tanto, la biología y
la química, están estrechamente relacionadas; en la evaluación de las aguas
naturales y contaminadas juegan papeles complementarios. [8].
Al tener en cuenta el papel
fundamental que desempeñan los macroinvertebrados en los sistemas fluviales, se
tiene como objetivo evaluar la presencia de dichos organismos a partir de una
comparación espacial y temporal de las comunidades biológicas del río San
Lorenzo, a partir de la desviación del cauce para la implementación de
estanques con fines productivos.
2.
MATERIALES Y METODOS
La cuenca hidrográfica del Río San
Lorenzo está ubicada en jurisdicción del municipio de El Carmen de Viboral, el
cual está situado al suroriente del Departamento de Antioquia, en la subregión
Valles de San Nicolás, con coordenadas geográficas de 6º05'09" de latitud
norte y 75º20'19" longitud Oeste, a una altura sobre el nivel del mar de
2150 m, y con una temperatura promedio de 17ºC [10].
En el río San Lorenzo se ubicaron
seis (6) estaciones de muestreo en puntos estratégicos observados directamente
en campo; Estación 1 (E1) antes de la desviación del cauce para la
implementación de los estanques piscícolas (condiciones naturales y línea base
de comparación con el resto). Estación 2 (E2) remanente de agua del canal
pluvial por donde pasaba el cauce natural antes de la intervención (corredor
hiporréico). Estación 3 (E3) después del retorno del agua que sale de los
estanques al cauce natural del río (salida de las trucheras). Estación 4 (E4)
aguas abajo al lado de la escuela de la vereda San Lorenzo. Estación 5 (E5) en
donde recibe un tributario de bajo orden (turbio). Estación 6 (E6) punto sobre
la zona del puente que comunica hacia la escuela de San Lorenzo y sitio posible
para una futura bocatoma del acueducto municipal de El Carmen de Viboral (Figura
1 - 2).
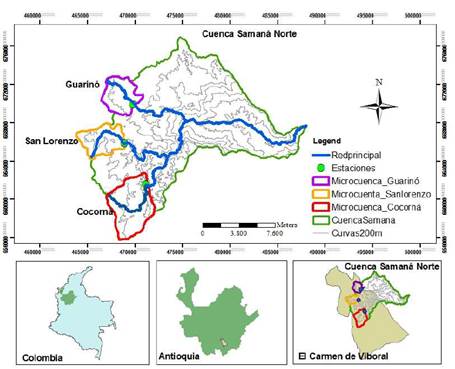
Figura 1. Ubicación espacial del Río San
Lorenzo (Tomado de Botero-Álvarez, 2019)
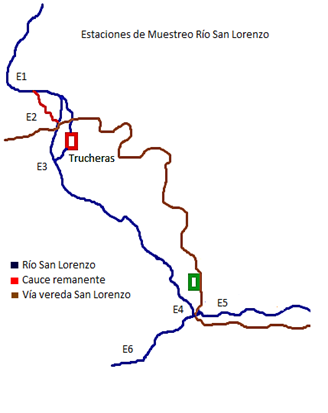
Figura 2. Ubicación espacial de las estaciones.
Muestreo
Para la medición de las variables
fisicoquímicas del agua y la recolección de las muestras biológicas, cada
estación fue visitada en cuatro ocasiones durante los meses de noviembre de
2018, febrero, marzo y mayo de 2019 en diferentes momentos pluviométricos.
Variables fisicoquímicas
Para determinar la calidad
fisicoquímica del agua, estos sitios de muestreo fueron visitados durante
periodos hidrológicos diferentes en una ventana temporal de siete (7) meses con
una periodicidad bimensual y se registraron in situ parámetros como el
pH, conductividad eléctrica, oxígeno disuelto, porcentaje de saturación de
oxígeno, temperatura del agua, sólidos totales disueltos evaluados mediante un
equipo multiparámetro WTW.
Se tomaron muestras de agua en cada estación
para el análisis en el laboratorio de agua de la facultad de Ingeniería de la
Universidad de Antioquia, en el que se evaluaron los siguientes parámetros:
nitratos, nitritos, fósforo soluble reactivo y hierro por medio de métodos colorimétricos
y espectrofotométricos.
Macroinvertebrados
bentónicos
Los macroinvertebrados
fueron colectados a contracorriente por medio de una red, con réplica en cada
lugar de muestreo y se complementó con recolecciones manuales de organismos
adheridos a las piedras mediante pinzas. Los especímenes colectados fueron
depositados en una solución de alcohol al 90% en recipientes de plásticos
debidamente rotulados con fecha y lugar de recolección, para su posterior
identificación a nivel de familia. Esta colecta, permitió realizar un análisis
cuantitativo de las morfoespecies de macroinvertebrados con respecto a su
riqueza de taxa y abundancia en el sitio de colección a partir de claves
taxonómicas especializadas [11], [3], [12], [13],
[14]. Con el listado de familias reportadas
se calculó el índice BMWP/Col. [6]
Análisis de datos
Los datos obtenidos en los 4
muestreos fueron sometidos a un análisis exploratorio mediante el uso de
estadísticos de tendencia central (media aritmética) y de dispersión
(coeficiente de variación relativa de Pearson, C.V). Se realizó un análisis de
correspondencia canónica rectificado (DCCA) para identificar la longitud del
gradiente y luego se hizo un análisis de redundancia canónica (RDA) en donde se
integraron los géneros más importantes, las variables evaluadas y los sitios de
colecta, para identificar los patrones de distribución de los
macroinvertebrados acuáticos. Los análisis estadísticos mencionados se efectuaron
con el paquete estadístico Statgraphics Centurion XV y Canoco 5.0. Los índices
comunitarios se calcularon mediante el paquete PAST.
Índices
En los análisis de las comunidades de
macroinvertebrados bentónicos, se aplicaron índices ecológicos, que
involucraron cuatro elementos sobre las estructuras de las comunidades
bióticas: riqueza, equidad, dominancia y abundancia. Adicional a estos índices
se calculó el índice BMWP/Col. [6] para evaluar la calidad biológica del agua
en las estaciones de muestreo.
3. RESULTADOS
Características
Climáticas y Fisicoquímicas:
Se realizaron cuatro muestreos durante el ciclo hidrológico que comprende
un período húmedo durante el mes de noviembre de 2018, seguidamente, un periodo
seco entre los meses de febrero y marzo, y finalmente, un regreso de la
temporada húmeda durante el mes de mayo de 2019 en donde se obtienen las
últimas muestras.
Las variables fisicoquímicas
registradas en el Río San Lorenzo durante los muestreos realizados en las
diferentes estaciones presentaron las siguientes variaciones: la temperatura
del agua (°C) presentó una temperatura inferior (15°C) en la estación E3
(salida de truchera) en el mes de marzo y una temperatura mayor (20,5°C) en la
misma estación en el mes de febrero. El pH mostró un valor mayor de 7,99 en la
estación E5 (afluente turbio) en el mes de febrero y un valor inferior de 6,2
en la estación E2 (corredor hiporréico) en los meses de febrero y mayo. El
oxígeno disuelto (ppm) presentó una concentración alta de 7,83 en la estación
E3 en el mes de noviembre de 2018 y una concentración baja de 3,92 en la estación
E2 en el mes de mayo. La Saturación de oxígeno (%) fue sobresaturada con un
nivel alto de 105, 5% en la estación E1 (antes de derivación) en los meses de
noviembre y marzo y un valor subsaturado de 51,7% en la estación E2 en el mes
de marzo. La Conductividad eléctrica (µS/cm) registró un valor alto de 31 en la
estación E2 en el mes de febrero y un mínimo valor mínimo de 15 en la estación
E4 (claro) en el mes de mayo. Los Sólidos Totales Disueltos (STD) (mg/l)
presentaron un valor alto de 35 en la estación E2 en el mes de febrero y un
valor mínimo de 16 en las estaciones E5 en el mes de noviembre y E1 y E4 en el
mes de mayo. La concentración de NO3 (mg/l) presentó un valor mayor
de 2,8 en la estación E6 (unión) en los meses de febrero y mayo y un valor inferior
de 0,01 en la estación E4 en los meses de noviembre y marzo. La concentración
de NO2 (mg/l) fue mayor en la estación E2 con un valor de 0,009 en
los meses de noviembre y marzo y menor en la estación E5 con un valor de 0,001
en los mismos meses. La concentración de PO4 (mg/l) presentó valores
altos de 6,72 en la estación E5 en los meses de noviembre y marzo y valores
bajos de 0,06 en la estación E6 en los mismos meses. Finalmente, la
concentración de Fe (mg/l) presentó valores elevados en la estación E2 con
valores de 2,9 en los meses de noviembre y marzo y valores mínimos en la
estación E4 con valores de 0,11 en los meses de febrero y mayo (Tabla 1).
Según los datos registrados, se encontraron niveles bajos en la estación E2
(corredor hiporréico) con relación al pH (6,2) en los meses de febrero y mayo;
el oxígeno disuelto (ppm) presentó concentración baja (3,92) en el mes de mayo;
la saturación de oxígeno (%) mostró un porcentaje bajo (51,7) en el mes de
marzo; la Conductividad eléctrica (µS/cm) registró un valor alto (31) en el mes
de febrero; los Sólidos Totales Disueltos (STD) (mg/l) registraron un valor
alto (35) en el mes de febrero; la concentración de NO2 (mg/l) fue
mayor (0,009) en los meses de noviembre y marzo; el último registro de las
variables que se tomaron, fue la concentración de Fe (mg/l) que presentó un
valor alto (2,9) en los meses de noviembre y marzo. Todos estos rangos de
valores muestran el grado de afectación de la estación corredor hiporréico en
comparación con las demás estaciones de muestreo.
Con respecto al coeficiente de variación de las variables fisicoquímicas,
las podemos agrupar en los siguientes grupos: las poco variables (CV <20 %)
tales como el pH, el oxígeno disuelto, el % de saturación, la temperatura del
agua y la conductividad eléctrica; las de variación intermedia
(20%>CV<50%) como los sólidos totales disueltos; y las variables de
variación alta (CV>50%), tales como los nitratos, los nitritos, fosfatos y
el hierro (Tabla 2).
Las condiciones fisicoquímicas del agua indican que las aguas
del Río San Lorenzo son frías, con pH circum-neutral, oxigenadas con saturación
alta, aguas poco mineralizadas (conductividad eléctrica y sólidos totales
bajos), con bajas concentraciones de nitratos, nitritos e intermedia para el
fósforo soluble reactivo.
Tabla 2. Medidas de tendencia
central y de dispersión de las variables físicas.
|
Variables
|
Media
|
Máximo
|
Mínimo
|
C.V (%)
|
|
Temperatura del agua (°C)
|
16,30
|
20,50
|
15,00
|
6,88
|
|
pH (unidades de pH)
|
6,96
|
7,99
|
6,20
|
6,70
|
|
Oxígeno disuelto (ppm)
|
6,94
|
7,83
|
3,92
|
18,81
|
|
Saturación de oxígeno (%)
|
94,41
|
105,50
|
51,70
|
18,96
|
|
Conductividad eléctrica
(µS/cm)
|
21,73
|
31,00
|
15,00
|
19,06
|
|
STD (mg/l)
|
22,13
|
35,00
|
16,00
|
21,59
|
|
NO3 (mg/l)
|
0,90
|
2,80
|
0,01
|
121,02
|
|
NO2 (mg/l)
|
0,00
|
0,01
|
0,001
|
53,071
|
|
PO4 (mg/l)
|
1,33
|
6,72
|
0,05
|
144,03
|
|
Fe (mg/l)
|
0,54
|
2,90
|
0,11
|
145,70
|
Variables Biológicas:
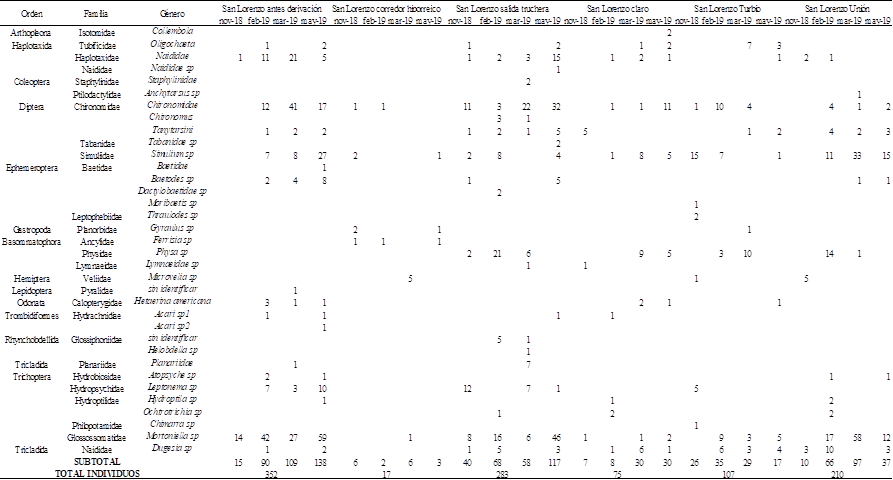
En la tabla 3 se presentan los
macroinvertebrados recolectados mediante el método cuantitativo durante las
campañas de toma de muestras realizadas en los meses de noviembre de 2018,
febrero, marzo y mayo de 2019. En el Río San Lorenzo se recolectaron un total
de 35 géneros pertenecientes a 27 familias y 1044 ejemplares de
macroinvertebrados pertenecientes a los phylum platyhelminthes, annelidae,
mollusca y arthropoda.
Del total de las taxas colectadas, la
mayor riqueza corresponde a los tricópteros con seis (6) géneros, seguida por
los dípteros y efemerópteros con cinco (5) géneros respectivamente y los haplotáxidos
y basommatoforos con tres (3) géneros cada uno. Las familias que presentaron
mayor abundancia fueron Haplotaxidae, Chironomidae, Simuliidae,
Glossossomatidae y Naididae. En éstas se observó que, en la mayoría de las
estaciones de muestreo durante el período hidrológico, la diferencia de esta
distribución se presentó en la estación San Lorenzo corredor hiporréico (E2) en
donde hubo una menor presencia de taxas.
En la estación E1 (antes de
derivación) predominan los tricópteros Mortoniella sp (Glossossomatidae)
seguidos por los dípteros Chironomidae (Chironomidae) y Simulium sp
(Simuliidae). En la estación E2 corredor hiporréico la ausencia de taxas e
individuos es un indicador del impacto generado por el cambio del cauce y la
reducción del flujo.
En la estación E3 salida truchera
predominan los tricópteros Mortoniella sp (Glossossomatidae)
seguido por los dípteros Chironomidae (Chironomidae), Basommatophoros Physa
sp (Physidae), Haplotaxida Naididae (Haplotaxidae)
respectivamente. En la estación E4 claro no se encuentra un número
representativo de individuos por familia. En la estación E5 afluente turbio
predominan los dípteros Simulium sp (Simuliidae) seguido por los
tricópteros Mortoniella sp (Glossossomatidae). En la estación E6
hubo una presencia importante de los tricópteros Mortoniella sp
(Glossossomatidae) seguidos por los Dípteros Simulium sp
(Simuliidae).
El mes de mayo de 2019 fue el mes que
registró el mayor número de macroinvertebrados bentónicos colectados durante
los muestreos hechos en las seis estaciones del Río San Lorenzo, seguido por el
mes de marzo del mismo año. Es de resaltar la estación E1 antes de desviación
en donde el número de individuos supera las otras cinco estaciones, lo cual se
entiende a razón de que es la zona menos intervenida del sistema.
Frente a la distribución espacial y
temporal las taxas Naididae, Chironomidae, Tanytarsini, Simulium y
Mortoniella estuvieron presentes en la mayoría de las estaciones de
muestreo durante la corriente del río San Lorenzo, a diferencia de la estación
E2 corredor hiporreico en donde hubo una disminución del total de individuos
colectados (sólo diecisiete 17 ejemplares) y de varias familias de
macroinvertebrados acuáticos Chironomidae, Simulium sp, Gyraulus
sp, Ferrisia sp, Microvelia sp y Mortoniella
durante todo el tiempo de muestreos.
Algunas taxas como Collembola solo se
encontraron en la estación San Lorenzo claro (E4), Naididae, Tabanidae,
Helobdella y Staphylinidae en la estación San Lorenzo salida truchera (E3), Anchytarsus
en la estación San Lorenzo Unión (E6), Baetidae y Acari sp2 en la estación San
Lorenzo antes derivación (E1) y Moribaetis, Chimarra y Thraulodes
en la estación San Lorenzo afluente turbio (E5).
En la Tabla 4 se pueden evidenciar
variaciones en los valores de los índices comunitarios, la cantidad de Taxas e
individuos y los valores del índice BMWP/Col en las diferentes estaciones de
muestreo, en donde la estación con mayores valores de diversidad de
macroinvertebrados, es la estación E1 con un valor mayor en el mes de mayo;
mientras que la estación E2 corredor hiporréico presento valores inferiores
durante todas las muestras, siendo el mes de febrero el más bajo.
En relación al índice de Dominancia
de Simpson, los valores obtenidos en las diferentes campañas de muestreo
presentaron variaciones en los valores obtenidos, los valores inferiores se
encuentran en la estación E1 con un valor mínimo de 0.12 para el mes de
noviembre de 2018 lo que se relaciona con mejor estabilidad ambiental de la
zona y en la estación E4 se encontraron el valor máximo de 0.84 en el mes de
febrero de 2019,lo que puede obedecer al impacto generado por la salida de las
aguas de la explotación piscícola cargadas de nutrientes.
Tabla 4. Valores de los índices comunitarios, número
de taxas e individuos y BMWP.
|
ESTACIÓN Y FECHA DE MUESTREO
|
Número de taxa
|
Número de individuos
|
Diversidad Shannon- Weaver
|
Dominancia Simpson
|
Equidad de Pielou
|
BMWP/col
|
|
E1 San lorenzo antes derivación
|
Noviembre de 2018
|
2
|
15
|
0,24
|
0,12
|
0,35
|
8
|
|
febrero de 2019
|
12
|
90
|
1,76
|
0,73
|
0,71
|
66
|
|
Marzo de 2019
|
10
|
109
|
1,65
|
0,75
|
0,71
|
50
|
|
Mayo de 2019
|
15
|
138
|
1,81
|
0,75
|
0,67
|
73
|
|
E2 San lorenzo corredor hiporréico
|
Noviembre de 2018
|
4
|
6
|
1,33
|
0,72
|
0,96
|
21
|
|
febrero de 2019
|
2
|
2
|
0,69
|
0,50
|
1,00
|
8
|
|
Marzo de 2019
|
2
|
6
|
0,45
|
0,28
|
0,65
|
15
|
|
Mayo de 2019
|
3
|
3
|
1,10
|
0,67
|
1,00
|
19
|
|
E3 San lorenzo salida truchera
|
Noviembre de 2018
|
10
|
40
|
1,80
|
0,79
|
0,78
|
43
|
|
febrero de 2019
|
11
|
68
|
1,99
|
0,82
|
0,83
|
45
|
|
Marzo de 2019
|
12
|
58
|
1,97
|
0,80
|
0,79
|
54
|
|
Mayo de 2019
|
12
|
117
|
1,73
|
0,75
|
0,69
|
55
|
|
E4 San lorenzo claro
|
Noviembre de 2018
|
3
|
7
|
0,80
|
0,45
|
0,72
|
13
|
|
febrero de 2019
|
7
|
8
|
1,91
|
0,84
|
0,98
|
35
|
|
Marzo de 2019
|
8
|
30
|
1,74
|
0,79
|
0,84
|
36
|
|
Mayo de 2019
|
9
|
30
|
1,85
|
0,79
|
0,84
|
38
|
|
E5 San Lorenzo afluente
|
Noviembre de 2018
|
7
|
26
|
1,33
|
0,62
|
0,69
|
50
|
|
febrero de 2019
|
5
|
35
|
1,54
|
0,78
|
0,96
|
34
|
|
Marzo de 2019
|
7
|
29
|
1,69
|
0,78
|
0,87
|
25
|
|
Mayo de 2019
|
7
|
17
|
1,76
|
0,80
|
0,90
|
33
|
|
E6 San Lorenzo Unión
|
Noviembre de 2018
|
3
|
10
|
1,03
|
0,62
|
0,94
|
16
|
|
febrero de 2019
|
10
|
66
|
1,94
|
0,83
|
0,84
|
37
|
|
Marzo de 2019
|
7
|
97
|
0,94
|
0,53
|
0,48
|
37
|
|
Mayo de 2019
|
7
|
37
|
1,49
|
0,71
|
0,77
|
40
|
Con respecto al índice de Diversidad
Shannon Weaver encontramos valores bajos, con resultados cercanos a la unidad
durante todos los muestreos y en todas las estaciones. La estación San Lorenzo
antes de derivación, presentó el valor más bajo durante el mes de noviembre;
mientras que la estación San Lorenzo salida de truchera, presentó el valor más
alto durante el mes de febrero para este índice. Para el índice de Equidad de
Pielou su distribución indicó una tendencia uniforme por medio de los valores
cercanos a uno (1) a excepción de la estación San Lorenzo antes de derivación
en donde el valor es de 0,35 para el mes de noviembre de 2018. En general, el
índice nos mostró que la mayor parte de las especies son igualmente abundantes
como se muestra en la Tabla 4.
En relación con los índices
comunitarios se presentaron valores bajos respecto al número de taxa, el cual
oscilo entre 2 y 15. La estación E2 (estación corredor hiporréico) evidenció
los menores valores para el número de taxa (2-3), el número de individuos
(2-6), el índice de diversidad de Shannon y el BMWP/Col.
La estación E1 es la estación en la
parte más alta que se evaluó del río, además que se ubicó antes de la zona de
la derivación del sistema hídrico; en esta zona el Río San Lorenzo presentó los
mayores valores numéricos de taxa e individuos, índice de diversidad, equidad y
del BMWP/Col.
El índice BMWP/Col mostró los
puntajes más altos en la estación E1 que evidencia una calidad de aguas
moderadamente contaminadas para los meses de noviembre, febrero y marzo, y unas
aguas ligeramente contaminadas para el mes de mayo; comparada con las demás
estaciones, nos muestra una calidad de agua menos contaminada, contrario a la
estación E2 San Lorenzo corredor hiporréico en donde los puntajes registraron valores
generales de aguas fuertemente contaminadas. Aunque hay que aclarar que este
bajo valor más que indicar contaminación orgánica, es reflejo de la ausencia de
flujo, por la desconexión al río.
Las demás estaciones, presentaron
puntajes que indican calidad de aguas moderadamente contaminadas y muy
contaminadas, las cuales generan dificultades para su utilización como posible
fuente abastecedora para el acueducto del municipio de El Carmen de Viboral.
En la tabla 5 se evidencian las
variables fisicoquímicas y el porcentaje de varianza explicado para cada uno de
los componentes principales, en negrilla se resaltan las relaciones
estadisticamente significativas. En el eje 1 se observa que la concentración de
oxígeno disuelto y su saturación presentó los valores positivos más altos,
mientras que la conductividad eléctrica y los sólidos totales los mayores
valores negativos. En el eje 2 los valores de los vectores son bajos y ninguno
presento significancia estadística. No obstante, el modelo planteado alcanza una
explicación del 40% de la varianza de la comunidad.
Tabla 5. Variables seleccionadas para el análisis
multivariado.
|
Variable
|
Eje 1
|
Eje 2
|
|
pH (unidades de pH)
|
0,60
|
0,01
|
|
Oxígeno disuelto (ppm)
|
0,70
|
-0,06
|
|
Saturación de oxígeno (%)
|
0,72
|
-0,12
|
|
Temperatura del agua (°C)
|
0,05
|
0,20
|
|
Conductividad eléctrica
(µS/cm)
|
-0,78
|
-0,19
|
|
Sólidos Totales Disueltos
(mg/l)
|
-0,79
|
-0,18
|
|
NO3 (mg/l)
|
0,57
|
-0,14
|
|
NO2 (mg/l)
|
0,02
|
-0,17
|
|
PO4 (mg/l)
|
-0,18
|
-0,3
|
|
Fe (mg/l)
|
-0,39
|
-0,13
|
El RDA generó un porcentaje de
varianza total explicado del 40% (p=0.02), por lo tanto, se sugiere que la
correlación entre los macroinvertebrados y las variables ambientales fue
significativa. Para este análisis se usaron 10 variables (Tabla 5). El RDA
evidencia que entre las variables fisicoquímicas de mayor peso para la
comunidad está la conductividad eléctrica, la concentración de oxígeno
disuelto, los sólidos totales disueltos, los nitratos y el fósforo soluble
reactivo.
Las variables cuyos vectores
presentaron mayor tamaño evidencian posiciones opuestas, mostrando una relación
inversa entre la concentración de sólidos totales disueltos, el hierro, la
conductividad eléctrica y los ortofosfatos, respecto a la concentración de
oxígeno disuelta-porcentaje de saturación, nitratos y pH. La temperatura del
agua presentó un patrón diferente al anterior, en el que se relacionan con el
primer muestreo.
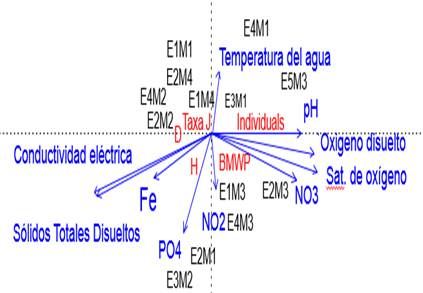
Figura 3. RDA triplot entre la
comunidad de macroinvertebrados, variables ambientales y estaciones y momentos
de muestreo. Los puntos representan las seis estaciones y cuatro muestreos, las
líneas azules simbolizan las variables ambientales y los íconos rojos los
índices comunitarios.
El índice BMWP/Col se asoció con la
concentración de nitratos y de oxígeno disuelto. En forma inversa con la
conductividad eléctrica, los sólidos totales y la concentración de fósforo; los
índices comunitarios se ubicaron en el centro del grafico por lo que no
evidenciaron relaciones marcada con las variables ambientales medidas.
Al graficas los valores promedios del
BMWP/Col para las estaciones de muestreo (Figura 4) evidencia que las
condiciones del Río San Lorenzo pese a estar poco poblada su rivera, evidencia
contaminación orgánica, evidenciándose que en la zona de la estación1 sin
intervención las aguas ya registran un grado leve de contaminación, la cual se
acentúa en la E3 después de recibir la descarga de las aguas de la truchera,
las cuales no tienen tratamiento previo. El afluente que recibe el río en la E5
presenta una turbiedad marcada por el transporte de sedimentos, lo que
disminuye la biota de macroinvertebrados, pero puede generar dilución de la
carga de nutrientes, tal así que en la E6 el sistema logra estabilizar la carga
orgánica y vuelve a registrar las condiciones de calidad biológicas que tenía
antes de recibir las aguas de las trucheras.
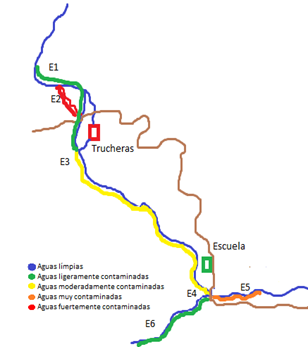
Figura 4. Variación de la calidad
biológica del agua por medio de píndice BMWP/Col.
La estación E2 se excluye del
análisis anterior, ya que más que contaminación, evidencia una desconexión del
sistema fluvial, la cual pese a los 20 años que han pasado, interrumpe la
continuidad del río.
4.
DISCUSIÓN
La desviación del Río San Lorenzo
para apresar su caudal con el objetivo de derivar sus aguas para el
establecimiento de estanques para truchas, supuso la reducción del caudal
circulante lo que pudo llegar a retraer el caudal del sistema pluvial, dejando
el curso seco en un tramo de 100m. Dichas actividades sumadas a otras acciones
de origen antrópico, afectan la dinámica de los ecosistemas acuáticos [15];
[16]; [17]; [18]; [19];[20].
La temperatura en el Río San Lorenzo
presentó un valor promedio de 16,3 °C, valor que favorece mantener niveles
óptimos de oxígeno disuelto. Esta variable es de suma importancia debido a que,
en condiciones de alta temperatura, disminuye el oxígeno disuelto; aumentando
la actividad bacteriana y la sensibilidad de la biota acuática a ciertos
componentes tóxicos [5].
La concentración de oxígeno disuelto
tuvo valores promedio subsaturados, con un valor medio cercano a 7 mg/L y con
rango ligeramente inferior, cuyo valor menor a 4 mg/L se encontró en la E2, lo
que indica un nivel adecuado para la vida acuática [8], para el caso de peces
se establece que debe ser mayor a 4 mg/L [21]. Estos autores afirman que este
valor está relacionado con los valores de nitrato y fosfato que para el caso
del Río San Lorenzo se registra un nivel de nitrato de 0,90 mg/L valores
cercanos al límite inferior de las aguas tropicales colombianas, lo que indica
unos niveles bajos frente al uso de agroquímicos y vertimientos domésticos que
generalmente son ricos en nitrógeno. La concentración de fosfato registró un
valor de 1,33 mg/L que indicarían un ambiente mesotrófico; valores superiores
están asociados con factores como materia orgánica proveniente de vegetación
rivereña, descargas sólidas y líquidas de actividades domésticas y agrícolas.
Las concentraciones de fosfato en el agua actúan como nutriente que favorece el
alto crecimiento de algas y causa eutrofización.
El pH en el Río San Lorenzo, presentó
un valor promedio de 6,96, que se encuentra dentro de los límites permisibles
establecidos en la calidad del agua potable que debe estar entre 6,5 y 9,0 [5].
Según el autor, este criterio es fundamental debido a que puede originar
alteraciones en la composición faunística y florística de los cuerpos de agua;
así como un aumento de la influencia de ciertos compuestos tóxicos. Desde el
punto de vista de los valores de las aguas naturales, los valores registrados
en estas investigaciones son normales [21].
La conductividad eléctrica presentó
un valor promedio de 21,7 μS/cm, muy por debajo del rango establecido para ríos
de montaña que oscilan entre 30 – 60 μS/cm [5]. Resultados inferiores a estos
valores indican baja productividad [20].
Los sólidos totales disueltos (STD)
presentaron un valor promedio de 22,1 mg/L estando por debajo de los límites
establecidos para hábitats acuáticos cuyo valor es de 100 mg/L. Bajas
concentraciones favorecen la disponibilidad de oxígeno.[5]; [21].
En el Río San Lorenzo los
macroinvertebrados más abundantes son del orden Trichoptera, familia
Glossossomatidae. Este orden se caracteriza por tener taxas que normalmente son
intolerantes a la contaminación por lo que su número poblacional disminuye con
el aumento de esta [22]. Esta familia no se reportó en la E2, probablemente
debido a que al ser constructores de casas requieren granos de arena para tal
fin y la ausencia de flujo limita al máximo el arrastre de este tipo de
material.
Las familias Baetidae y
Leptophlebiidae pertenecientes al orden Ephemeroptera, Hydropsychidae del orden
Trichoptera y Chironomidae del orden Díptera son las familias que registran una
mayor distribución espacio temporal. La familia Leptophlebiidae se destaca por
el género Thraulodes. La distribución de esta familia en aguas naturales se
considera limitada por su alta sensibilidad a alteraciones ambientales [23].
,[24]. Esta sensibilidad a la contaminación se evidenció con su presencia en
cinco de las seis estaciones de muestreo.
La familia Hydropsychidae se
colectaron individuos del género Leptonema sp en las estaciones San
Lorenzo antes de derivación y salida de trucheras. Las taxas pertenecientes a
esta familia se encuentran en todo tipo de corrientes, utilizan piedras,
troncos y hojarasca para construir refugios y se relacionan con altos niveles
de oxígeno [14], aunque pueden soportar cierto grado de contaminación orgánica.
La familia Chironomidae se
caracterizó por la abundancia y diversidad de dípteros en las seis estaciones
de muestreo, aunque en la estación E2 corredor hiporréico es la de menor número
de individuos recolectados. [25] mencionan que es una familia de los grupos de
dípteros con mayor diversidad y abundancia, condiciones importantes que
permiten identificar el amplio papel que cumplen en el funcionamiento de un
reoambiente.
Los resultados obtenidos tras la
aplicación del índice BMWP/Col e índices comunitarios indicaron el deterioro
de la calidad del agua, especialmente en la Estación E2, ya que la ausencia de
flujo y la desconexión con el cauce principal limita los procesos de
colonización y deriva de los macroinvertebrados acuáticos, entre los cuales se
observa una sustitución de los taxones característicos de aguas de cabecera (Tanytarsini,
Hetaerina americana, Acari, varios géneros de tricópteros como Atopsyche,
Leptonema e Hydroptila) por un grupo de taxones más tolerantes como moluscos
(Ferrisia sp y Physa sp) y una reducción del más del 85% de la
riqueza de taxa.
La composición de macroinvertebrados
en los diferentes períodos hidrológicos no presentó diferencias significativas,
esto puede estar relacionado al hecho de que en la región tropical las
estaciones climáticas no son muy marcadas. Resultados similares fueron
encontrados por [26] quienes plantearon que estos resultados pueden deberse a
la falta de réplicas que permitan hacer comparaciones entre periodos climáticos.
Pese a que el cambio del cauce se
realizó hace más de 20 años, el agua que conforma el corredor hiporréico
evidencia diferencias en riqueza, abundancia de macroinvertebrados acuáticos y
de calidad biológica del agua respecto a las aguas del Río antes del cambio de
cauce. La zona hiporréica (HZ, Hyporheic Zone) es una zona donde se dan
importantes procesos de intercambio de solutos y transformación de nutrientes.
Su existencia ha sido ampliamente documentada y estudiada tanto en ríos de
montaña, como en ríos de planicie. Sin embargo, en Colombia no se ha realizado
casi estudios de caracterización de la zona hiporréica en corrientes naturales [27].
Otro aspecto a mencionar tiene que
ver con la reducción del bosque rivereño y la construcción de un “tapón” de
cemento que impide que el agua fluya por su antiguo cauce. La vegetación de
ribera desempeña un papel importante en la preservación del recurso hídrico y
en la estabilización de los cauces; actúa como corredor de dispersión de la
biota y como albergue para la fauna en época seca, además las riberas
constituyen un sistema de redes interconectadas con el resto de ecosistemas
adyacentes (corredor bioecológico), por lo cual su conservación y restauración
no se pueden considerar de manera aislada, sino a escala de cuenca hidrográfica
[28]; [29].
La alteración del cauce de un río
reduce considerablemente el aporte de material alóctono y autóctono lo que
afecta la disponibilidad de alimentos, material de refugio, variación de las
condiciones fisicoquímicas del agua respecto al cauce principal, incluso se
evidenció una colonización excesiva de las rocas por parte del perifiton,
especialmente algas verdes filamentosas.
Se observó que en la estación E2 la intervención
realizada hace 20 años sigue impactando el cuerpo de agua remanente, el cual
según [30] no ha logrado recuperarse, ya que no contiene suficientes recursos
bióticos y abióticos como para continuar su desarrollo sin ayuda o subsidio
adicional. Este ecosistema se mantiene tanto estructural como funcionalmente
simplificado y no demuestra capacidad de recuperación dentro de los límites
normales de estrés y alteración ambiental. Presenta poca interacción con
ecosistemas contiguos en términos de flujos bióticos y abióticos e
interacciones culturales.
5.
CONCLUSIONES
Pasados
20 años después de ser intervenido un ecosistema se esperaría que tienda a
restaurarse por sí solo (resiliencia, adaptación al disturbio, disipación de la
entropía); en el caso del tramo del Río San Lorenzo en la estación E2 corredor
hiporréico, el Río no alcanzo a restaurarse debido al poco flujo hidrológico
por este tramo. La poca biodiversidad encontrada en el agua, es evidencia de
las malas condiciones de la misma.
La
poca presencia de macroinvertebrados en el tramo intervenido por la derivación
del Río San Lorenzo, es el resultado de las condiciones actuales de parte de un
ecosistema acuático que no ha logrado restablecerse y que en algún momento fue
parte de un sistema dinámico estable. A la luz del BMWP este tramo presenta
condiciones críticas.
Las
condiciones fisicoquímicas del agua reflejan una baja mineralización, lo cual
puede ser indicador de unos suelos meteorizados con bajo impacto antrópico;
respecto a la concentración de nutrientes, los fosfatos presentan valores por
encima del promedio de la zona, lo que refleja el impacto de la industria de la
trucha en el río.
El
municipio de El Carmen de Viboral debe velar por el cuidado de este río, por lo
que debe requerir a los propietarios de la truchera para que realicen un plan
de manejo de la misma y de forma urgente, al menos, generar un sistema de
tratamiento básico que limite la salida de nutrientes de la truchera al río San
Lorenzo.
En
segunda instancia, se debe hacer un seguimiento a la identificación de otras
fuentes de contaminación, para implementar pozos sépticos y seguir reduciendo
los aportes externos al río. También se recomienda continuar con el monitoreo
de la calidad del agua del rio San Lorenzo para verificar si las medidas
tomadas se reflejan en un mejoramiento de las condiciones fisicoquímicas y
biológicas del agua.
6.
AGRADECIMIENTOS
A
la Universidad Pontifica Bolivariana a través de la Facultad de Ingeniería y el
programa de posgrado, por el apoyo y acompañamiento durante el proceso
formativo.
A
la Universidad de Antioquia a través del Grupo de Investigación GeoLimna y al
Municipio de El Carmen de Viboral por la financiación del proyecto BIOPROSPECCIÓN
DE LOS RÍOS SAN LORENZO, GUARINÓ Y COCORNÁ, MUNICIPIO DE EL CARMEN DE VIBORAL,
ANTIOQUIA, que dio origen a este trabajo.
7.
REFERENCIAS BIBLIOGRÁFICAS
[1] CORTOLIMA. (2004). II
Fase Diagnostico - Río Coello. L-2.11 Calidad de Aguas. 111(479), 1009–1010.
[2] Conesa, C., & Pérez,
P. (2014). Alteraciones geomorfológicas recientes en los sistemas fluviales
mediterráneos de la península ibérica. Síntomas
y problemas de incisión en los cauces. Revista de Geografía Norte Grande,
2014(59), 25–44.
[3] Roldán P., G. (1988).
Guía para el estudio de los Macroinvertebrados acuáticos del departamento de
Antioquia. 217p. Medellín: Universidad de Antioquia.
[4] Ballarin, D., &
Rodríguez, I. (2013). Hidromorfología fluvial. 126.
[5] Gualdrón, L. E. (2018).
Evaluación de la calidad de agua de ríos de Colombia usando parámetros
fisicoquímicos y biológicos. Dinámica Ambiental, (1), 83–102.
Disponible en: https://doi.org/10.18041/2590-6704/ambiental.1.2016.4593 [consultado el 30 de agosto de 2019].
[6] Roldán, G. (2003).
Bioindicación de la calidad del agua en Colombia: propuesta para el uso del
método BMWP/ Col. (p. 142). p. 142. Medellín: Universidad de Antioquia.
[7] González, S., Ramírez,
Y., Mesa, A. M., & Dias, L. (2012). Diversidad De Macroinvertebrados
Acuáticos Y Calidad De Agua De Quebradas Abastecedoras Del Municipio De
Manizales. Boletín Científico. Centro de Museos. Museo de Historia Natural,
16(2), 135–148.
[8] Bustamante, P., &
Angulo, A. M. (2018). Prevalencia de las familias de Macroinvertebrados como
Bioindicadores de la calidad de agua en dos ecosistemas del Ecuador
continental. Escuela
Superior Politécnica de Chimborazo. Orellana.
[9] Roldán, G. (2016). Los
macroinvertebrados como bioindicadores de la calidad del agua: cuatro décadas
de desarrollo en Colombia y Latinoamérica. Revista de La Academia Colombiana
de Ciencias Exactas, Físicas y Naturales, 40(155), 254.
[10] CORNARE. (2006)
Subregión Valles de San Nicolás. Disponible:
http://www.cornare.gov.co/contenidos.php?seccion=2&id=2. [Consultado: 28 de enero 2006]
[11] McCaffertty,
W. P. Aquatic Entomology. Boston: Science Books International. 1981.
[12] Merritt, R. y K.
Cummins. An Introduction to
the Aquatic Insects of North America. Dubuque:
Kendall/Hunt Publishers. 1996.
[13] Álvarez, L. F. (2006).
Metodología para la utilización de los macroinvertebrados acuáticos como
indicadores de la calidad del agua. Instituto Alexander von Humboldt.
[14] Dominguez, E., &
Fernández, H. R. (2009). Macroinvertebrados bentónicos sudamericanos.
Sistemática y biología ISBN (Vol. 1975). Tucumán Argentina: Fundación
Miguel Lillo.
[15] Obando, N. L., &
Bustamante, C. A. (2014). Macroinvertebrados y algas perifíticas de la quebrada
Cajones, unidad de manejo de cuenca UMC Río Espejo municipio de Montenegro,
Quindío, Colombia. Revista de La Asociación Colombiana de Ciencias
Biológicas, 26, 133–144.
[16] Morales, S., Salazar, M.
D. R., & Urrea, J. D. (2016). Composición y estructura de la comunidad de
macroinvertebrados y perifiton del río Ejido, Popayán – Cauca. Revista de
Ciencias, 20(2), 16. Disponible en: https://doi.org/10.25100/rc.v20i2.4670 [consultado el 28 de agosto de 2019].
[17] Arias, L. M., Duque, A.,
Meneses, S., & Ramírez, J. E. (2016). Estrategias de mitigación de impactos
ambientales implementadas en el proyecto hidroeléctrico de Sogamoso. The
British Journal of Psychiatry, 111(479), 1009–1010. Disponible en:
https://doi.org/10.1192/bjp.111.479.1009-a [consultado el 31 de agosto de
2019].
[18] Ruiz, J. A., Vélez, F.
de J., Caicedo, O., & Aguirre, N. J. (2016). Modelación espacial de la
calidad del agua en el río Tapartó, municipio de Andes, Antioquia, Colombia. Revista
Mutis, 6(1), 16–27.
[19] Díaz, J. A., &
Granada, C. A. (2018). Efecto de las actividades antrópicas sobre las
características fisicoquímicas y microbiológicas del río Bogotá a lo largo del
municipio de Villapinzón, Colombia. Revista de La Facultad de Medicina, 66(1),
45–52. Disponible en: https://doi.org/10.15446/revfacmed.v66n1.59728 [consultado el 31 de agosto de 2019].
[20] Escobar, A. F., &
Montoya, Y. (2019). Los macroinvertebrados acuáticos y la calidad biológica del
agua en una quebrada andina, Antioquia-Colombia. (p. 15). p. 15. Revista
Politécnica. https://doi.org/10.33571/rpolitec.v15n29a6
[21] Roldán,
G., & Ramírez JJ. Fundamentos de Limnología Neotropical.
Editorial Universidad de Antioquia, Medellín. 2008.
[22] Prat, N., Ríos, B.,
Acosta, R., & Rieradevall, M. (2009). Los macroinvertebrados como
indicadores de la calidad de las aguas. Macroinvertebrados bentónicos
sudamericanos. sistemática y biología. 631–654. Disponible en http://www.ub.edu/fem/docs/caps/2009
MacroIndLatinAmcompag0908.pdf
[consultado el 30 de agosto de 2019].
[23] Murillo, M., Caicedo,
O., Hernández, E., Grajales, H., Mesa, J., Cortés, F., Aguirre, N. (2016). Aplicación
de tres índices bióticos en el río San Juan, Andes, Colombia. 6(2),
59–73.
[24] Raimundi, E. (2010).
Ecología de Leptophlebiidae bank, 1900 (Insecta: Ephemeroptera). Santa
Catarina: No oeste de Santa Catarina, Universidades comunitéria da região de
chapecó. Programa de Pós-Graduação em Ciências Ambientais.
[25] Porinchu, D., &
MacDonald, G. (2003). The use
and application of freshwater midges (Chironomidae: Insecta: Diptera) in
geographical research. Progress in Physical Geography, 27(3), 378-422.
[26] Meza, A.M.,
Rubio-M, J., Días, L.G. Valteros, J.M. (2012). Calidad de agua y composición de macroinvertebrados acuáticos en la
subcuenca alta del río Chinchiná. Caldasia. 34 (2): 443-456.
[27] Amaya-Toro, L. 2016.
Identificación de la zona hiporreica en un río sinuoso de montaña. Caso de
Estudio - Quebrada Aguas Claras, La Calera, Cundinamarca. Trabajo de pregrado
Universidad Nacional de Colombia Facultad de Ingeniería. Bogotá.
[28] Naiman, R.
J., Bison, P. A., Lee, R. G. & TURNER, M. (1998). Watershed Management,
Chapter 26 (pp. 642-661). En R. J. NAIMAN & R. E. BILBY (Eds.), River
Ecology and Mangement: lesson from the Pacific Coastal Ecoregion. New York: Springer-Verlag.
[29] Guevara, G; Reinoso, G;
García, J; Franco, M; García, J; Yara, D; Briñez, N; Ocampo, M; Quintana, M;
Pava, D; Flórez, N; Ávila, M; Hernández, E; Lozano, L; Guapucal, M; Borrero, D.
y Olaya, E. 2008. Aportes para el análisis de ecosistemas fluviales: una visión
desde ambientes ribereños. Revista
Tumbaga (2008), 3, 109-127.
[30] Poff, L.,
Allan, J. D., Bain, M. B., Karr, J. R., Prestegaard, K. L., Richter, B.,
Sparks, R. & Stromberg, J. (1997). The natural flow regime: a paradigm for
river conservation and restoration. BioScience, 47, 769-784.