1.
INTRODUCCIÓN
Colombia en su división política cuenta con 33
departamentos y 1051 municipios; 10 de estos albergan el 70%
de la población [1] y generan demanda sobre el recurso
hídrico. Un caso a partir del cual se puede analizar el
proceso y problemáticas locales asociadas con la demanda de
agua, es representado por el Oriente Antioqueño, las
proyecciones de población del Plan de Gestión Ambiental
Regional CORNARE del año 2014 indican que para el año 2034, la
región contará con 796.078 habitantes, lo que se traduce en un
incremento aproximado del 15% en relación con el año 2020,
donde se estima una población de 681.739 habitantes [2]. Este
crecimiento demográfico y las actividades relacionadas con el
desarrollo de las comunidades como las labores domésticas,
industriales, agrícolas, entre otras [3], ha llevado a generar
preocupación por la disminución en cantidad y calidad del
recurso hídrico, lo cual genera el análisis de conflictos
sociales por el acceso al recurso y la disponibilidad del agua
por una distribución poco equitativa [4].
Así las cosas, se hace necesario ahondar en el
estudio de los ríos andinos en la zona del Oriente Antioqueño,
dichos sistemas acuáticos se ven afectados por este
crecimiento demográfico. En términos físicos, estos ríos
presentan condiciones particulares en el relieve, la
topografía, tipos y usos de suelo; así, los ríos alto andinos
muestran gran variabilidad en los caudales, aumentando en su
magnitud a medida que avanza la red hídrica, además de sumar
los cambios topográficos del terreno principalmente altitud y
pendiente [5], adicionalmente la disminución de lámina de agua
para aprovisionamiento del recurso hídrico en sus diversos
usos.
Esta variabilidad física de las corrientes, incide
sobre los componentes fisicoquímicos, lo que genera
fluctuaciones en las concentraciones de estos; en ese sentido,
variables como pH, oxígeno disuelto, temperatura del agua,
conductividad eléctrica y los nutrientes nitrógeno y fósforo,
representan algunas de las variables más relevantes en los
sistemas acuáticos y que a su vez, se ven alteradas en aumento
o disminución en sus concentraciones debido a factores como
contaminación por vertimientos de aguas residuales, pérdida de
vegetación de ribera, entre otros factores [6], [7], [8], [9],
[10].
Estas variaciones hidráulicas y fisicoquímicas
mencionadas, alteran la composición, estructura, colonización
y permanencia de las plantas acuáticas asociadas a las
corrientes naturales, dado que estas comunidades biológicas,
responden a cambios de dichas variables en el tiempo [11],
[12].
Otra de las características que determina la calidad
de los ríos altoandinos está relacionada con los usos de
suelo, dado que los diversos usos pueden aportar contaminación
ya sea por plaguicidas en actividades agrícolas o
contaminación microbiológica por ganadería o aguas residuales
domésticas, entre otras causas. Ahora bien, en Colombia los
ríos altoandinos por sus diversos hábitats, variedad en las
presiones ambientales y usos del suelo, forman parte de un
escenario de interés con respecto a la diversidad en la
comunidad florística y su respuesta a condiciones ambientales
[13], [14]; este tipo de vegetación, es la que crece en zonas
húmedas, principalmente ríos y lagos al interior de la masa de
agua o parcialmente sumergida, otorgando a los sistemas
acuáticos gran valor ecológico, dado que son biotopos
fundamentales para albergar diversidad de fauna y microfauna
como bacterias, hongos, macroinvertebrados acuáticos, e
incluso perifiton y algas; adicionalmente estas plantas
presentan características importantes en relación a la
depuración de las aguas de forma natural y puede incluso
llegar a regular en ciertos periodos climáticos los flujos de
caudal; además de presentar una amplia distribución
relacionada con sus tipos de crecimiento y condicionantes
ambientales por lo que son organismos que presentan una alta
diversidad biológica [15], [16], [17], [18], [19], [20].
Los ríos de alta montaña presentan características
físicas y fisicoquímicas particulares, estas pueden
condicionar la presencia y distribución comunitaria de los
organismos que se allí de desarrollan, en este caso la
vegetación acuática y semiacuática que cumple su ciclo de vida
en estos ecosistemas húmedos y que puede presentar variación
dados los cambios en la fisicoquímica de los ríos.
Es
importante mencionar que las investigaciones relacionadas con
este tipo de vegetación en Colombia son escasas, y en las que
se encuentran disponibles, se hace un esfuerzo inicial en la
identificación de los organismos, hábitos de vida y en pocos
casos, se realizan algunas relaciones entre la distribución de
los organismos y algunas variables ambientales [13], [14],
[21], [22]. Sin embargo, los estudios no avanzan en aspectos
importantes, como determinar la interacción de los cambios en
la variabilidad fisicoquímica de los ríos y cómo esta puede
afectar la distribución comunitaria de la vegetación acuática
y riparia asociada.
Por lo anterior, se plantea la pregunta de
investigación de cómo es la relación entre la estructura de la
comunidad de plantas acuáticas y semiacuáticas con las
variables fisicoquímicas en tres estaciones de ríos
altoandinos; adicionalmente se plantea la hipótesis de que la
estructura de la comunidad de hidrófitos está influenciada por
las condiciones hidráulicas como caudal, además de la
influencia en la presencia y distribución de las plantas por
variables fisicoquímicas, entre las que se destacan la
temperatura, la conductividad eléctrica y los nutrientes; para
ello se propone como objetivo determinar la estructura de la
comunidad de la vegetación acuática y semiacuática para tramos
de las cabeceras de tres ríos andinos, y su posible relación
con las algunas variables hidráulicas y fisicoquímicas de las
fuentes hídricas.
2.
MATERIALES Y METODOS
Área
de
estudio:
El
área de estudio de las estaciones Cocorná, San Lorenzo y
Guarinó asociadas a sus ríos del mismo nombre, se encuentran
ubicadas en la zona noroccidental del municipio de El Carmen
de Viboral, oriente del departamento de Antioquia en la parte
alta de la cuenca del río Samaná Norte, afluente del río
Magdalena.
En
la figura 1 se identifican las tres estaciones de muestreo,
estos tramos monitoreados se encuentran en zona de vida de
bosque húmedo montano bajo (bh-MB) a unas altitudes de 2.289,
2.364 y 2.239 m.s.n.m. para las estaciones Cocorná, San
Lorenzo y Guarinó respectivamente.
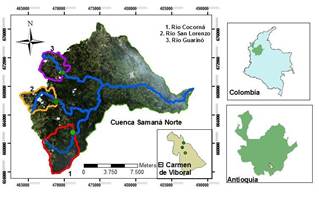
Fig.
1. Ubicación espacial de las estaciones de muestro
(Colombia – Antioquia – El Carmen de Viboral – Cuenca Samaná
Norte y estaciones).
Para
cada una de las estaciones que se muestran en la figura 1 se
evidencia una microcuenca asociada, para las cuales se tiene
un área específica de drenaje. A continuación, en la tabla 1
se muestran las áreas de drenaje de cada una de las subcuencas
de interés.
Tabla 1. Área de drenaje de
subcuencas y porcentaje de usos de suelo
|
Subcuenca
|
Área
de drenaje (km2)
|
Porcentaje
(%) de uso de suelo
|
|
Bosque
|
Pasto
|
Suelo
Desnudo
|
|
Cocorná
|
22,1
|
73,3
|
13,0
|
13,7
|
|
San
Lorenzo
|
12,1
|
40,6
|
38,6
|
20,8
|
|
Guarinó
|
12,3
|
28,9
|
50,7
|
20,4
|
Se
observa
que el área del río Cocorná es la que más parche de bosque
asociado tiene, por lo cual su intervención antrópica en las
inmediaciones del cauce es la menor, además presenta un
sustrato donde predominan rocas con diámetros entre 0,05 m y
1,5m; caso contrario para las estaciones San Lorenzo y
Guarinó, que se evidenció en esta investigación un área de
pastos y suelos desnudos mayor, por lo que su afectación en
relación a la intervención humana es más alta, para la
estación San Lorenzo el sustrato predominante es roca con
diámetros entre los 0,05m y 1,0m y para la estación Guarinó se
presenta un lecho donde dominan las arenas.
Metodología
de
campo, toma y medición de muestras fisicoquímicas y
biológicas:
El
trabajo de campo se desarrolló en cuatro campañas de
monitoreo en los días 1 y 2 de noviembre de 2018 (periodo
lluvioso-Meso templado sin periodo seco), 12 y 13 de febrero
de 2019 (periodo seco-Meso templado con periodo seco), 26 y
27 de marzo de 2019 (periodo seco-Meso templado con periodo
seco), 14 y 15 de mayo de 2019 (periodo lluvioso-Meso
templado sin periodo seco). En cada estación se delimitó un
tramo de 100m longitudinalmente para la toma de muestras
fisicoquímicas y biológicas.
Para la
medición de variables fisicoquímicas se determinó el punto
central del tramo donde el flujo presentara estabilidad;
allí se midieron in situ con un equipo
multiparamétrico WTW 3630 IDS temperatura del agua,
conductividad eléctrica, sólidos totales disueltos, oxígeno
disuelto, porcentaje de saturación de oxígeno y pH; para la
turbiedad se utilizó un HACH 2100Qis; también se determinó
CO2 disuelto en el agua por medio de titulación
con NaOH con una normalidad de 0,01N, es de resaltar que
todos los equipos fueron calibrados antes de comenzar la
medición.
Variables como fósforo total, alcalinidad total,
color aparente, color verdadero, nitrógeno total Kjeldahl,
sólidos suspendidos totales, sólidos totales, coliformes
termotolerantes, coliformes totales y Escherichia coli
fueron medidas en el Laboratorio de Estudios Ambientales y
GDCON, ambos certificados por el IDEAM adscritos a la
Universidad de Antioquia.
Las variables restantes, DQO, dureza cálcica y
magnésica, ortofosfatos, nitritos, nitratos, nitrógeno
amoniacal se midieron con kits Nanocolor y
Visocolor, para la lectura de datos de se empleó un
fotómetro PF-12 Macherey Nagel. En el caso de variables como
nitritos, nitratos y ortofosfatos, se empleó un kit de
reactivos HACH y para la medición de los datos, un
espectrofotómetro HACH ODYSSEY DR2500, estos equipos
pertenecen al grupo de investigación GeoLimna y el
Laboratorio de Hidrobiología Sanitaria de la Universidad de
Antioquia.
Para el levantamiento de las variables físicas
como profundidad del cauce, ancho de sección y caudal, se
emplearon cintas métricas, profundímetro, y correntómetro
Global Water Flow Probe para medición de velocidades; para
el lecho se hizo una caracterización visual y tener un
referente cualitativo del mismo.
Para la toma de muestras biológicas, dentro del
tramo de 100m definido, este fue dividido en cinco secciones
de 20m. En cada
una de las líneas se tomaron muestras de los organismos en la
margen derecha en la zona de transición agua – tierra, centro
de la corriente y margen izquierda en la zona de transición
agua – tierra, el muestreo se realizó en este orden en todos
los monitoreos; para la medición de los organismos en los tres
sitios, se siguió la metodología [23], se dispuso de un
cuadrante de 1m de lado (1 m2 en total); en cada
una de estos cuadrantes se tomaron fotografias y registro vivo
del número de individuos por taxa; en algunos casos fue
necesario tomar muestras de los organismos de difícil
identificación para analizar con la ayuda de claves
taxonómicas [17], [18], [22], [24], [25] y la asesoría
de un experto botánico del herbario de la Universidad de
Antioquia.
Para la conservación de la vegetación, siguiendo las
recomendaciones de [26], se utilizaron bolsas herméticas con
una solución de alcohol al 70%; la medición de la biomasa se
desarrolló con una metodología propuesta, en esta se midió el
peso húmedo de las plantas una vez con réplica para tener una
masa promedio en kg, para tomar las plantas se media la
porción de área que esta ocupaba en el cuadrante de 1 m2
y se registraba en una tabla; posteriormente con las
fotografias tomadas y el software ImageJ se media el área que
ocupaban cada una de las plantas y con relación a esa área se
daba el peso en los demás cuadrantes.
Análisis
estadístico:
Se
desarrolló un análisis descriptivo con medidas de tendencia
central y de dispersión para conocer el comportamiento de las
variables de interes y cuales de ellas presentaban mayor
variabilidad, además de verificar si estas se ajustaban a una
distribución normal; para comprobar la normalidad en los datos
se aplicaron las pruebas de Shapiro Wilk (para muestras <
50 observaciones) para las variables fisicoquímicas y de
Kolmogorov-Smirnoff (para muestras > 50 observaciones) para
las variables biológicas.
Posteriormente
se corrió un Análisis de Componentes de Varianza – ACV; con
este se determinó si los factores muestreo (1,2,3,4) o
estación (Cocorná, San Lorenzo y Guarinó) presentaban mayor
influencia sobre la variabilidad y significancia de las
variables. Teniendo este análisis, para los cuales se obtuvo
una influencia > 30% del factor sobre la variable en el
ACV, se elaboró una tabla con las variables y se desarrolló un
Análisis de Varianza de una vía con una prueba no paramétrica
de Kruskal-Wallis. En ese sentido, se redujo la dimensión del
número de variables considerando tres criterios básicos; la
sólidez de las observaciones, donde se evidenciaba que la
variable o sus datos faltantes no superara el 75% del total de
datos; la significancia en la variabilidad teniendo en cuenta
el análisis descriptivo; y la influencia del medio acuático
sobre las plantas desde una mirada ecosistémica.
Al
final, se desarrolló un análisis multivariado para conocer qué
variables tenían mayor influencia sobre la estructura de las
plantas. Para el análisis, primero se corrió un Análisis de
Correspondencia sin Tendencia – DCA para saber que tipo de
prueba podría utilizarse, para un Análisis de Correspondencia
Canónica – CCA la longitud del gradiente debía ser > 3,5 y
para un Análisis de Redundancia – RDA esta misma debía ser
< 2,5, con esta prueba se corroboró que el RDA era el más
adecuado, dado que el gradiente ambiental fue < 2,5 [30]
Todos los análisis estadísticos fueron trabajando
con los software R3.6.1 para los cuales fueron utilizados los
paquetes lattice, grid, cwhmisc, permute y vegan; además del
software Statgraphics Centurion XVI.II.
3.
RESULTADOS
Caracterización
fisicoquímica
Dado
el número de muestreos desarrollados, se obtuvo un total de 12
observaciones para la consolidación de la matriz
fisicoquímica. En la tabla 2, se muestran todas las variables
fisicoquímicas que fueron medidas en el trabajo de campo. De
estas variables se procedió a descartar las que
tuvieran menor relevancia en términos de variabilidad dentro
del análisis.
En
la tabla 3 se muestran las variables fisicoquímicas que fueron
establecidas como matriz de variables explicativas dentro del
análisis posterior.
Tabla 3. Medidas de tendencia
central y dispersión de variables fisicoquímicas
|
Variable
|
Promedio
|
Min
|
Max
|
C.V. (%)
|
|
Caudal medio (m3/s)
|
1,18
|
0,23
|
4,34
|
105,23
|
|
pH (Unidades de pH)
|
6,62
|
5,09
|
7,31
|
10,59
|
|
Temperatura del Agua (°C)
|
16,42
|
14,70
|
18,70
|
8,22
|
|
Conductividad eléctrica (µS/cm)
|
21,09
|
6,27
|
41,10
|
53,84
|
|
Turbiedad (UNT)
|
6,75
|
1,33
|
28,30
|
119,72
|
|
Nitrógeno total soluble (mg/L N)
|
0,83
|
0,00
|
2,68
|
104,79
|
|
Ortofosfatos (mg/l PO43--P)
|
0,26
|
0,00
|
2,19
|
240,02
|
La
tabla 3 muestra las variables que cumplieron los tres
criterios de selección que se propusieron en la metodología,
en esta tabla se evidencia que variables como caudal,
conductividad eléctrica, turbiedad, nitrógeno total soluble y
ortofosfatos presentaron un % de variación > 40% por lo
cual dentro de los muestreos fueron observaciones con mucha
variabilidad, mientras que variables como pH, y temperatura
del agua permanecieron muy estables. Dicha variabilidad y
distancias entre máximos y mínimos para cada variable estuvo
relacionada con los periodos climáticos en que se
desarrollaron los muestreos y las diferencias entre las
características de las tres estaciones en cuestión.
Tabla 2. Matriz de variables
fisicoquímicas completa
La
tabla 2 muestra información relevante para posteriores
investigaciones, dado que como línea base aporta elementos
para el entendimiento de la fisicoquímica de las estaciones
que fueron objeto de esta investigación; dentro de las
variables que aparecen con datos marcados como <LCM- Límite
de cuantificación del método, implica que estas variables
presentaros datos inferiores a los que podía reportar el
equipo de medición; adicionalmente, las casillas N.D- No Dato,
implica que allí no fue posible tener el valor de medición por
errores en la toma de la muestra de agua en campo.
Caracterización
biológica
Se determinaron un
total de 22 taxa que estaban distribuidas por los tres
sistemas acuáticos, estos organismos se presentaron de la
siguiente manera.
Para
la estación Cocorná se encontraron organismos de la familia
Lycopodiaceae: Lycopodium sp.; Myrtaceae;
Asteraceae: Ageratina sp.; Rubiaceaea: Gallium sp.;
Cyperaceae: Cyperus sp., Eleocharis filiculmis;
Oxalidaceae: Oxalis sp.; Dryopteridaceae:
Elaphoglossum sp.; Thelypteridaceae:
Thelypteris sp.; Blechnaceae: Blechnum cordatum
y Marchantiaceae: Marchantia sp.
Para
la estación San Lorenzo se encontraron organismos de la
familia Cyperaceae: Cyperus
mindorensis,
Cyperus
carex,
Rhynchospora sp., Eleocharis filiculmis; Apiaceae:
Hydrocotyle umbellata; Thelypteridaceae:
Thelypteris sp.; Blechnaceae: Blechnum cordatum;
Marchantiaceae: Marchantia sp. y Brachytheciaceae:
Platyhypnidium aquaticum.
Para
la estación Guarinó se encontraron organismos de la familia
Cyperaceae: Eleocharis
filiculmis; Apiaceae:
Hydrocotyle umbellata, Centella asiatica; Juncaceae: Juncus
microcephalus;
Polygonaceae: Polygonum
puntactum;
Potamogetonaceae:
Potamogeton
paramoanus;
Zingiberaceae : Hedychium coronarium; Thelypteridaceae:
Thelypteris sp.; Marchantiaceae: Marchantia sp.
y Brachytheciaceae: Platyhypnidium
aquaticum.
Igual
que para las variables fisicoquímicas, las variables
biológicas respuesta se filtraron al tener en cuenta los
mismos criterios, en la tabla 3 se muestran las cuatro
variables respuesta que fueron utilizadas.
Tabla
4. Medidas de tendencia central y dispersión de variables
biológicas
|
Variable
|
Promedio
|
Min
|
Max
|
C.V. %
|
|
Diversidad Shannon Weaver
|
1,26
|
0,77
|
2,02
|
42,40
|
|
Riqueza de especies
|
8,00
|
5,00
|
11,00
|
22,00
|
|
Abundancia (Ind./m2)
|
18,00
|
0,00
|
130,00
|
159,85
|
|
Biomasa total (kg/m2)
|
498,88
|
0,00
|
2972,41
|
131,88
|
De la tabla anterior se evidencia un % de variación bajo para
la riqueza, variable que describe el número de taxa, este pudo
haber sido bajo dado que para cada río en general se
repitieron las mismas especies, pero haciendo una comparación
entre las tres estaciones hubo algunas diferencias entre las
mismas; mientras que las demás variables alcanzaron
variaciones > 40% lo que implica que estas fluctuaron más
entre muestreos y estaciones.
Con respecto a la
misma tabla es importante mencionar que la presencia de
organismos fue marcada por la siguiente tendencia; en el río
Cocorná los organismos que mayor abundancia fueron las
Myrtaceas, Eleocharis filiculmis, Oxalis sp y Thelypteris
sp; mientras que en el río San Lorenzo las Cyperaceas
marcaron la riqueza pero en muy pocas abundancias; por último
el río Guarinó, aunque presentó riqueza similar al San Lorenzo
este tuvo la menor abundancia, incluso con muchos cuadrantes
sin organismos, allí se evidenció abundancia de Hydrocotyle
umbellata y Centella asiatica. Ahora
comparando
entre ríos, el río Cocorná presentó las mayores abundancias,
segudo del San Lorenzo y el Guarinó respectivamente. En
términos de Diversidad, el río San Lorenzo era el mas diverso,
seguido de las otras dos corrientes.
Análisis
estadístico
multivariado
El
Análisis
de Redundancia–RDA arrojó un porcentaje de explicación del
modelo 87,8%, distribuidos en 47,8% para el componente 1 y
40,0% para el componente 2. Adicional a esto el R2
es 1 por lo cual el modelo indica que toda la variabilidad de
las variables biológicas está determinada por las variables
fisicoquímicas del sistema, este ajuste es posible que se haya
dado, teniendo en cuenta que el número de observaciones era
bajo, por lo que toda esta variabilidad biológica se volcó
sobre las observaciones fisicoquímicas existentes.
A
continuación, en la figura 2 se muestra de manera gráfica los
resultados del RDA.
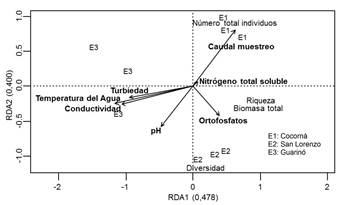
Fig.
2. RDA – Entre variables fisicoquímicas y biológicas.
El
análisis
anterior muestra el peso o importancia que tiene cada variable
fisicoquímica – explicativas, sobre cada variable biológica –
respuestas, por lo anterior, se puede plantear que las
relaciones encontradas pueden determinar la influencia de las
variables fisicoquímicas sobre las plantas acuáticas. Al tomar
en consideración el componente 1 (47,8%) las variables que
tuvieron una mayor influencia sobre biomasa y riqueza de las
plantas acuáticas fueron temperatura, conductividad y
turbiedad, de manera inversa, y nitrógeno total soluble de
manera directa; y para el componente 2 (40,0%) el caudal
influyó de manera directa sobre la abundancia de los
individuos y de manera inversa sobre la diversidad; mientras
que el pH y los ortofosfatos influyeron de manera directa
sobre la diversidad y de manera inversa sobre la abundancia.
4. ANÁLISIS DE RESULTADOS Y DISCUSIÓN
Según los resultados obtenidos se evidenció una
separación importante entre las estaciones en relación con su
hidráulica y estructura física, esto se debió principalmente a
que el río Cocorná presenta un caudal mayor en relación con
los otros dos sistemas de interés, además de sus diferencias
en términos de lecho, dado que el río Cocorná presentó un
sustrato con rocas de diámetro mucho mayor que los demás
sistemas, mientras que el río Guarinó presentó un lecho con
predominio de arenas.
Así mismo, se observaron variaciones en relación con
las variables fisicoquímicas, aunque estas fueron más
representativas entre sistemas que entre muestreos, caso
particular el del río Guarinó, donde se presentaron los
valores más altos de variables relacionadas con el transporte
de sedimentos, como turbiedad, conductividad eléctrica, color
aparente, sólidos suspendidos totales, entre otras. Lo que es favorecido por el predominio del
sustrato arenoso en el cauce del río, sustrato que no es
predominante en ríos de alta montaña, pero por los diversos
usos del suelo aguas arriba y en inmediaciones de la estación,
se ven alteradas las condiciones naturales de dicho sistema
Las variables fisicoquímicas medidas, presentan una
relación importante con la conformación de la estructura
biológica de interés, en otras investigaciones se ha
evidenciado que variables como conductividad y temperatura,
tipo de sustrato, nutrientes como nitrógeno y fósforo en sus
formas iónicas disponibles, caudal y velocidad de la
corriente, explican en gran medida la distribución y presencia
de la vegetación acuática [14], [35], [37], dichas variables
en el ecosistema natural influyen en el crecimiento de las
plantas como el caso de los nutrientes, por otra parte
variables como el caudal y temperatura condicionan la
presencia o ausencia de algunos taxa.
En lo que respecta a la estructura biológica se
evidenciaron cambios interesantes en la distribución de taxa
asociados principalmente a cada estación. Dado que el río
Cocorná presentó los valores más altos de abundancia, pero en
relación con la diversidad el río San Lorenzo tuvo lo mayores
valores, y por último el río Guarinó fue el sistema con
valores mínimos de diversidad y número de individuos.
El tipo de sustrato condicionó la presencia de
algunos individuos en la zona de ritral de cada sistema, caso
particular del río Cocorná, al tener un sustrato rocoso, se
observó de manera reiterada la colonización de especies como Ageratina
sp y Eleocharis filiculmis; así mismo, para el río
Guarinó que presentó un lecho principalmente arenoso, se
evidenció la colonización por parte la especie acuática
estricta Potamogeton paramoanus, como se ha encontrado
en otras investigaciones [31].
Los cambios en las dinámicas del flujo asociados a
variables como caudal pudieron afectar la distribución de las
plantas acuáticas, dado que algunos organismos son sensibles a
esos cambios, teniendo en cuenta que la morfología de dichos
individuos no les permite adaptarse de manera adecuada a estos
ambientes [32], [33], [34]. Se observaron diferencias de los
tipos de organismos y su distribución espacial en la masa de
agua, relacionadas con la abundancia y diversidad de los
mismos en los ríos Cocorná, San Lorenzo y Guarinó; además de
ello, investigaciones como [35] encontraron que los cambios de
caudal pueden afectar la colonización de especies, por tanto,
donde hay menores velocidades existe una mayor diversidad, lo
que se comprobó con la presente investigación, dado que el río
Cocorná presentó mayores velocidades y una menor diversidad de
especies comparado con las demás estaciones.
De
las variables fisicoquímicas se encontró que el nitrógeno,
fósforo, temperatura del agua, pH, conductividad eléctrica y
alcalinidad, son algunas de las variables que mayor influencia
tienen con el crecimiento de hidrófitos, lo cual está en
concordancia con lo planteado por otras investigaciones [36],
[37].
El
Análisis de Redundancia–RDA mostró agrupaciones entre
estaciones, por ejemplo, el río Cocorná tuvo afinidad con
caudales altos, allí se presentó menor diversidad, pero mayor
abundancia, esto debido a que el caudal funciona como presión
ambiental sobre los individuos lo que dificulta su
colonización y permanencia [35], lo contrario en el río San
Lorenzo, donde se observó mayor diversidad, pero los
individuos existentes no presentaron abundancias
significativamente altas en comparación con el Cocorná. Por
último, se observó que el río Guarinó tenía mayores magnitudes
en las variables fisicoquímicas como conductividad,
temperatura del agua y turbiedad, lo que pudo condicionar la
poca presencia de vegetación acuática.
Se evidenció que variables
como el caudal, afectaron la conformación de los organismos al
influir en la presencia o ausencia de unas u otras especies.
Caso particular, de las especies Hydrocotyle umbellata
y Centella asiatica que crecen en sistemas acuáticos
leníticos o ríos con velocidades bajas [38], dichas especies
fueron encontradas en el río Guarinó principalmente.
Adicionalmente, la planta del género Oxalis sp que
vive principalmente en sustrato rocoso y en bordes de ríos fue
encontrada principalmente en el río Cocorná [39].
Es importante considerar
que las plantas acuáticas pueden ser sensibles a los cambios
en las condiciones ambientales [40], en ese sentido las variables fisicoquímicas
como temperatura
del agua, conductividad eléctrica, pH, nitrógeno total soluble
y ortofosfatos se relacionaron con la
biomasa y riqueza de los organismos. Caso particular de
algunos organismos, como los briofitos, Marchantia sp
y Platyhypnidium aquaticum que necesitan grandes
cantidades de agua para sobrevivir, además de la presencia de
nutrientes como nitrógeno [36], [41], [42].
Otros
individuos como los pertenecientes a la familia Cyperaceae
encontrados en los muestreos, con mayor riqueza en el río San
Lorenzo necesitan mayor cantidad de nutrientes para cumplir su
ciclo de vida [43]. En contraste a lo reportado en [14]
quienes expresan que a mayores valores de temperatura y
conductividad se presentaron las mayores riquezas y
abundancias, en la presente investigación se evidenció lo
contrario, donde a mayores valores de temperatura y
conductividad caso de la estación Guarinó, se encontró menor
riqueza biológica, esto posiblemente por la diferencia en los
usos de suelo en comparación con las demás estaciones de
investigación.
5.
CONCLUSIONES
La presencia, distribución espacial y tipo de
vegetación acuática y semiacuática está influenciada de forma
directa por variables físicas como tipo de sustrato, dado que
las plantas pueden crecer más fácilmente en bases sólidas con
algunas fisuras como las rocas del río Cocorná, y el caudal,
teniendo en cuenta que su magnitud permite que algunas plantas
pueden desarrollarse mejor, es el caso de las plantas de la
familia Myrtaceae y una Cyperaceae (Eleocharis filiculmis)
encontradas, que tienen unas raíces más sólidas, estas fueron
muy abundantes en el río Cocorná, donde se presentaron los
mayores caudales.
Las variables fisicoquímicas más importantes dentro
del análisis fueron el pH, conductividad, temperatura del
agua, turbiedad y nutrientes; la variabilidad de estas se
relacionó más con el tipo de río que con la campaña de
muestreo. Por consiguiente, los cambios en la estructura de la
comunidad de vegetación se asociaron en igual medida a los
tipos de ríos. Así las cosas, y como se mencionó en la
discusión, la fluctuación de estas variables fisicoquímicas
permite que organismos como las plantas acuáticas encontradas
puedan prosperar mejor en unos u otros ambientes.
La intervención antrópica,
derivada principalmente en obras de captación para suministro
de agua pueden disminuir de forma drástica la lámina de agua
principalmente en las estaciones San Lorenzo y Guarinó, por lo
que organismos como Cyperus sp, Cyperus
mindorensis, Cyperus carex, Rhynchospora sp, Oxalis
sp, Hydrocotyle umbellata, Hydrocotyle asiatica,
Juncus microcephalus y Polygonum puntactum que
se encontraron en la banca principalmente podrían resultar
afectadas por dicha pérdida de flujo, dado que los caudales
naturales mantienen un nivel de agua que hace posible que los
organismos puedan cumplir su ciclo de vida.
6. AGRADECIMIENTOS
Los autores agradecen a la Universidad de Antioquia
y al municipio de El Carmen de Viboral por la financiación a
esta investigación; al grupo de investigación GeoLimna; al
laboratorio de Hidrobiología Sanitaria y Herbario de la
Universidad de Antioquia; a la Dra. Diana Agudelo por sus
aportes en el análisis estadístico; y por último a los
investigadores amigos que apoyaron el proceso.
7.
Referencias Bibliográficas
[1] IANAS. La calidad de agua en Colombia, Red regional
de Academias de Ciencias, 202-238, 2019
[2] CORNARE. PLAN DE GESTIÓN AMBIENTAL REGIONAL 2014-2032, El
Santuario, 2014.
[3] Gastañaga, M. Agua, saneamiento y salud, Peru. Rev.
Peru Med. Exp. Salud, 35(2):181-2, 2018
[4] Agudelo, R. El agua, Recuros estratégico del sigle
XXI, Medellin, Revista Facultad Nacional de Salud Pública.
23(1):91-102, 2005.
[5] Segnini, S. Chacón, M., Caracterización
fisicoquímica del hábitat interno y ribereño de rios andinos
en la cordillera de Mérida, Venezuela, ECOTROPICOS
18(1):38-61, 2005.
[6] Pasquini, A.I., Lecomte, K.L., Depetris, P.J. Geoquímica
de ríos de montaña en las Sierras Pampeanas: II. El río Los
Reartes, sierra de Comenchingones, provincia de Córdoba,
Revista de la Asociación Geológica Argentina, 59 (1): 129-140,
(2004).
[7] García-Alzate, C.A., Román-Valencia, C.,
Vanegas-Ríos, J.A., Arcila-Mesa, D.K. Análisis Fisicoquímico y
Biológico Comparado en Dos Quebradas de Alta Montaña
Neotropical, Revista de Investigaciones, Universidad del
Quindio, 17(1): 57-80. ISSN 1794-631X, 2007.
[8] Villamarín, C., Prat, N., Rieradevall, M. Caracterización
física, química e hidromorfológica de los ríos altoandinos
tropicales de Ecuador y Perú, Lat. Am. J. Aquat. Res, 42(5): 1072-108,
2014.
[9] Benjumea-Hoyos, C.A., Suárez-Segura, M.A.,
Villabona-González, S.L. Variación espacial y temporal de
nutrientes y total de sólidos en suspensión en la cuenca de un
río de alta montaña tropical, Rev. Acad. Colomb. Cienc. Ex.
Fis. Nat., 42(165):353-363, 2018.
[10] Galeano-Rendón, E., y Mancera-Rodríguez, N.J.
Efectos de la deforestación sobre la diversidad y la
estructura del ensamblaje de macroinvertebrados en cuatro
quebradas Andinas en Colombia, Revista de Biología Tropical,
66(4), 2018.
[11] Martinez, L.F., Donato, J. Efectos del caudal sobre la colonización de algas en
un río de alta montaña tropical (Boyacá, Colombia), Caldasia, 25(2):
337-354, 2003.
[12] Díaz-Quiroz, C., Rivera-Rendón, C.A. Diatomeas de
pequeños ríos andinos y su utilización como indicadoras de
condiciones ambientales, Caldasia,
26(2): 381-394, 2004.
[13] Schmidt-Mumm, U. Vegetación Acuática y Palustre de
la Sabana de Bogotá y Plano del Río Ubaté, Bogotá, Colombia:
Universidad Nacional de Colombia, 1998.
[14] Gómez-Rodríguez, A.M., Valderrama-Valderrama, L.T.,
Rivera-Rondón, C.A. Comunidades de macrófitas en ríos andinos:
composición y relación con factores ambientales, Acta biol. Colomb, 22(1):45-58, 2017.
[15] U.S. EPA. Methods for Evaluating Wetland
Condition: Using Vegetation to Assess Environmental Conditions
in Wetlands. Office of Water, U.S. Environmental Protection
Agency, Washington, DC., 2002.
[16] García Murillo, P. Estudio Palinológico del Género Potamogeton L. en la
Península Ibérica, Bot. Complutensis. 18:79-91, 1993.
[17] Giménez, P.T. Guia visual de campo: Macrófitos
vasculares de la cuenca del Ebro, España, 2009.
[18] Cirujano Bracamonte, S., Meco Molina, A., García
Murillo, P., Chirino Argenta, M.
Flora Acuática Española: Hidrófitos Vasculares, Real Jardín Botánico, CSIC, Madrid,
2014.
[19] Lasso, C. A., Rial, A., Colonnello, G.,
Machado-Allison A., Trujillo, F., (Editores). XI. Humedales de
la Orinoquia (Colombia- Venezuela), Serie Editorial Recursos
Hidrobiológicos y Pesqueros Continentales de Colombia,
Instituto de Investigación de Recursos Biológicos Alexander
von Humboldt (IAvH), Bogotá, D.C., Colombia, 2014.
[20] Quiñonez Oquendo, L.E., & Wagner Vega, K.
Inventario de Plantas Acuáticas y de Ribera Asociadas al Río
Toro Negro, Tributario del Río Grande de Manatí, San Juan,
Puerto Rico: Departamento de Recursos Naturales y Ambientales,
2016.
[21] Schmidt-Mumm, U. Vegetación acuática y palustre de
la parte alta de la hoya del río Namay (Albán, Cundinamarca),
Perez-Arbelaezia, 2(6-7) 9-41, 1988.
[22] Posada, J.A., & López, M.T. Plantas
Acuáticas del Altiplano del Oriente Antioqueño,
Medellín: Universidad Católica de Oriente, 2011.
[23]Aguirre, N. Hidrobiologia Sanitaria, Universidad
de Antioquia, Medellin- Colombia, 2013.
[24] Fernández-Alaez, C., Fernández-Alaez, M.,
Santiago Ibarlucea, N.F., Núñez Labra, G., Aboal Sanjurjo, M.
Id-Tax. Catálogo y claves de identificación de organismos del
grupo macrófitos utilizados como elementos de calidad en las
redes de control del estado ecológico, España, 2012.
[25] García, J.M., Sarmiento L.F., Salvador, M.,
Porras, L.S. Uso de bioindicadores para la evaluación de la
calidad del agua en ríos: aplicación en ríos tropicales de
alta montaña, Revisión Corta. UGCiencia, 23(1): 47-62, 2017.
[26] Ministerio de Agricultura, Alimentación y Medio
Ambiente. Protocolo de muestreo y laboratorio de Macrófitos en
ríos, España, 2015.
[27] Shannon, C.E., Weaver, W. The
mathematical theory of communication, The University of
Illinios Press, 1949.
[28] Simpson, E.H. Measurement of diversity,
Nature, 163(4148): 688, 1949.
[29] Pielou, G.A. Ecological Diversity, Wiley New
York, 1998.
[30] Legendre, P. & H.J.B. Birks. From
classical to canonical ordination. Chapter 8,
201-248, 2012
[31] Engloner, A.I, Szalma, E., Sipos, K., Dinka, M.
Occurrence and habitat preference of aquatic macrophytes in a
large river channel, Community Ecology 14(2): 243-248, 2013.
[32] Hrivnák, R., Oťaheľová, H., Gömöry, D.
Seasonal dynamics of macrophyte abundance in two regulated
streams, Cent. Eur. J. Biol, 4(2):241–249, 2009.
[33] Abati, S., Minciardi, M.R.,
Ciadamidaro, S., Fattorini, S., Ceschin, S. Response of
macrophyte communities to flow regulation in mountain streams,
Environ. Monit. Assess, 2016.
[34] Vukov, D., Ilić, M., Ćuk, M., Radulović, S., Igić,
R., Janauer, G.A. Combined effects of physical environmental
conditions and anthropogenic alterations are associated with
macrophyte habitat fragmentation in rivers - Study of the
Danube in Serbia, Science of the Total Environment,
634:780-790, 2018.
[35] Manolaki, P., Papastergiadou, E.
Environmental factors influencing macrophytes assemblages in a
middle-sized Mediterranean stream, River res. Applic, 2015
[36] Arocena, R., Mazzeo, N. Macrófitas acuáticas de
un arroyo urbano en Uruguay: Su relación con la calidad del
agua, Rev. Bio. Trop,
42(3):723-728, 1994.
[37] Manolaki, P., Papastergiadou, E. The
impact of environmental factors on the distribution pattern of
aquatic macrophytes in a middle-sized Mediterranean stream,
Aquatic Botany, 104: 34–46, 2013.
[38]
Álvarez, M., Ramírez, C., Deil, U. Ecología y
distribución de Hydrocotyle cryptocarpa speg. En
Sudamérica, Gayana Bot, 65(2):139-144, 2008.
[39] Alfonso, G.L., Prina, A.O., Muiño, W.A. Una
nueva especie del género Oxalis (Oxalidaceae) para la
provincia de Mendoza, Argentina, (San Isidro), Hickenia,
3(51):213-216, 2004.
[40] Tomás, P., Moreno, J.L., Aboal, M., Oscoz, J., Durán, C.,
Navarro, P. Evaluación del estado ecológico de los ríos de la
cuenca del río Ebro mediante el índice trófico de macrófitos
IVAM-G (Índice de Vegetación Acuática Macroscópica),
Limnetica, 35(1): 219-234, 2016.
[41] Lagos-López, M.I., Sáenz-Jiménez, F.A.,
Morales-Puentes, M.E. Briófitos reófilos de tres quebradas del
páramo de Mamapacha, Chinavita (Boyacá-Colombia), Acta
Biológica Colombiana, 13(1):143-160, 2008.
[42] García Martinez, S., Basilio B, H., Herazo V,
F., Mercado G, J. & Morales P, M. Diversidad de briófitos
en los Montes de María, Colosó (Sucre, Colombia), Colombia
Forestal, 19(1), 41-52, 2016.
[43] Chambers, P.A., Lacoul, P., Murphy, K.J.,
Thomaz, S.M. Global diversity of aquatic macrophytes in
freshwater, Rev. Hydrobiologia, 595:9-26, 2008.
[44] Villareal Q., J.A., Carranza P., M.A., Estrada
C., E., Rodríguez G., A. Flora riparia de los ríos Sabinas y
San Rodrigo, Coahuila, México, Acta Biológica Mexicana.
75:1-20, 2006.

