EVALUACIÓN DE LA
HIDRÓLISIS ENZIMÁTICA DE PLUMAS DE POLLO PARA LA OBTENCIÓN DE QUERATINA
Lilibeth
Viloria Sierra1, María Paula Azabache Zarta2, Rafael
Nikolay Agudelo Valencia3, Javier Adolfo Hernández Fernández4
1 Estudiante de ingeniería Ambiental, lilibeth-vilorias@unilibre.edu.co, 2 Estudiante de
ingeniería Ambiental, mariap-azabachez@unilibre.edu.co, 3 M. Sc., Docente de
planta, rafaeln.agudelov@unilibre.edu.co, 4 Ph. Dc., Docente de
planta, Universidad Jorge Tadeo Lozano, Javier.hernandez@utadeo.edu.co.
1, 2,3 Universidad Libre de
Colombia
RESUMEN
Esta
investigación evaluó la hidrólisis enzimática de plumas de pollo para la
obtención de queratina hidrolizada como alternativa de valorización de este
desecho generado
por la industria avícola. La hidrólisis se realizó con la enzima Genencor® Tan G plus, utilizando un
diseño experimental de tipo central compuesto, seleccionando como factores el pH
(8 a 9), la temperatura (20 °C a 30 °C) y la dosis de enzima (0.03 g a 0.05 g),
y como respuesta la concentración de proteína en el extracto empleando para
ello el método de Bradford y electroforesis en gel SDS-PAGE para conocer la
pureza. Los resultados se estudiaron por un análisis de varianza y por la
metodología superficie de respuesta obteniendo a un pH de 8, dosis de enzima de
0.03 g y temperatura de 25°C, una concentración máxima de 2.106 mg/mL siendo el
pH y la temperatura (°C) los factores significativos de la hidrólisis.
Palabras
clave:
Plumas, Hidrólisis enzimática, Queratina, Proteína, Valorización.
Recibido:
24 de Abril de 2019. Aceptado: 19 de Julio de 2019.
EVALUATION OF ENZYMATIC HYDROLYSIS OF POULTRY FEATHERS
FOR OBTAINING KERATIN
ABSTRACT
This research evaluated the
enzymatic hydrolysis of chicken feathers to obtain hydrolyzed energy as an
alternative to valorize this design generated by the poultry industry. The
hydrolysis was performed with the enzyme Genencor® Tan G plus, using an experimental
design of central compound type, selecting as factors the pH (8 to 9), the
temperature (20 ° C to 30 ° C) and the enzyme dose ( 0.03 g to 0.05 g), and in
response to the concentration of the protein in the extract using the Bradford
method and SDS-PAGE gel electrophoresis to determine the purity. The results
are studied by means of an analysis of the variance and the methodology of the
response surface obtaining a pH of 8, an enzyme dose of 0.03 g and a
temperature of 25 ° C, a maximum concentration of 2.106 mg / mL being the pH
and temperature (° C) The significant factors of hydrolysis.
Keywords: Feathers, Enzymatic hydrolysis, Keratin, Protein,
Valorization.
Cómo
citar este artículo: L. Viloria, M. Azabache, Y. Agudelo, J Hernández. “Evaluación
de la hidrólisis enzimática de plumas de pollo para la obtención de queratina”,
Revista Politécnica, vol. 15, no.30 pp.17-20, 2019. DOI: 10.33571/rpolitec.v15n30a2
1.
INTRODUCCIÓN
La industria avícola
genera distintos tipos de desechos tales como sangre, huesos, piel, vísceras y plumas.
Estas últimas, representan aproximadamente el 8% del peso vivo del ave de
corral [1], a pesar de la disponibilidad y de los bajos costos de las plumas, no
existen productos principales o aplicaciones a gran escala derivadas de estas [2].
La disponibilidad de plumas se puede fundamentar en que anualmente de 200
pollos se pueden generar 30 kg de estas [3].
La industria avícola
está en constante crecimiento y los mayores productores del mundo son EEUU,
Brasil, China y la Unión Europea que tiene una producción anual aproximadamente
de 11 millones de toneladas de carne de pollo [1]. El sector avícola también
ocupa un lugar importante en la producción colombiana, contribuyendo un
porcentaje significativo al PIB
Nacional, con una tasa de crecimiento del 6.6% del PIB para el sector pecuario
en el tercer trimestre de 2018 [4]. Los sistemas de producción avícola también
han conllevado al deterioro ambiental, dando lugar a la emisión de altas
concentraciones de gases de efecto invernadero como óxidos de nitrógeno, fósforo
y azufre [5].
En la búsqueda de
alternativas para el aprovechamiento de residuos del sector avícola, surge la
cuestión con relación a la valorización de las plumas de pollo, con lo cual se
espera lograr la disminución de emisiones como resultado de la incineración de este
residuo [6],
y de igual forma prevenir la ejecución de malas prácticas de disposición final,
tales como, la descarga de plumas a través de las tuberías de desagüe generando taponamientos que pueden
dar lugar a reacciones químicas con productos sulfurosos de olores desagradables
y posiblemente peligrosos para la salud [7].
Una alternativa para
el aprovechamiento de plumas de pollo es la obtención de queratina hidrolizada,
este proceso se ha realizado con el uso de Queratinasas obtenidas a partir de
Bacillus Spp, como resultado se determinó que es posible la hidrólisis enzimática
de harina de plumas de pollo utilizando Bacillus subtilis como productor de
proteasa [3]. La queratina hidrolizada ha sido también obtenida a partir de
hidrolasas, con lo cual se
satisface el interés en aumento del uso de materiales renovables y sostenibles [2].
Por otra parte y
teniendo presente el alto contenido proteico en los productos derivados de
animales como por ejemplo plumas, pelo, pezuñas y uñas; se hace claro que
existe el potencial de aprovechamiento de ellos con fines nutricionales o como
fertilizante [8], y para la elaboración de compost debido a su contribución en
el desarrollo de los microorganismos que enriquecen el suelo en nitrógeno y
fósforo [9]. Así mismo, la queratina siendo un componente rico en azufre puede
ser utilizada en la fabricación de cremas para solucionar problemas capilares [10],
a su vez las aplicaciones de la queratina soluble a nivel cosmético y
farmacéutico son amplias y variadas, de igual modo han surgido otros usos de la
queratina de plumas como componente de varias clases de compuestos y en tejidos
biodegradables [11].
Con respecto a la
queratina, es preciso señalar a las plumas como un residuo sólido que contiene 90%
de esta proteína, que tiene como función la protección y el soporte de las
capas externas de la epidermis [3], la queratina presenta alta resistencia a la
degradación natural. Adicionalmente en los
procesos de sacrificio las plumas se contaminan con desechos tales como sangre,
grasa, microorganismos y agua, hecho que puede causar una mayor resistencia a
la degradación natural. Debido a lo anterior, se considera la hidrólisis como
una alternativa, en la gestión de los residuos de plumas, este proceso se
constituye como una reacción de descomposición de sustancias por acción de las moléculas
de agua generando compuestos más solubles en la misma, es lento y requiere de parámetros
idóneos de temperatura, velocidad de agitación (rpm) y pH del medio reactivo.
La hidrólisis se realiza mediante el uso de catalizadores que aceleran la reacción,
de los cuales existen tres principales tipos, catalizadores ácidos, básicos y
enzimas [12]. Los
procesos de hidrólisis química generalmente implican el uso de sustancias tales
como sulfuro de sodio y borohidruro de sodio [13], agresivas con el ambiente
que a su vez pueden generar afectaciones a la salud de las personas [14,
15] , por este motivo se prefirió por llevar a cabo un proceso hidrolítico.
En
este artículo se presentan los resultados del proceso de hidrólisis enzimática
de plumas de pollo para el cual se empleó la enzima Genencor® Tan G plus (proteasa)
a distintos pH de
reacción (8.0, 8.5 y 9.0),
temperatura (20°C, 25°C y 30°C) y dosis de enzima (0.03, 0.04, 0.05. De acuerdo
a fabricante, la enzima Genencor® Tan G plus es útil a pH dentro de un rango de
7.0 hasta 11.0 (con un pH óptimo de alrededor de 8.6), también es efectiva en
el rango de temperatura de 25°C hasta 30°C, La enzima es derivada de una cepa
modificada genéticamente de Bacillus subtilis y según su fabricante resulta
útil en los procesos de preparación de cueros[16]. Para la aplicación descrita
en este trabajo se desconoce el rendimiento óptimo (en pH y temperatura °C) de
la enzima Genencor® Tan G plus, por tanto para disminuir los errores de los
ensayos se establecieron los valores de los niveles del diseño experimental muy
cerca de los límites previamente estipulados por el fabricante de la enzima.
Las proteasas son
enzimas que catalizan la hidrólisis de los enlaces peptídicos de las proteínas,
presentan la capacidad de romper enlaces peptídicos específicos, dependiendo de
la secuencia de aminoácidos de la proteína, o pueden reducir un péptido
completo a aminoácidos. La ecuación 1, que aparece a continuación resume el
mecanismo catalítico de una enzima proteasa sobre un sustrato proteico.
 (1)
(1)
E: Enzima, S:
Sustrato, P, P’ péptidos resultantes, Kx coeficiente cinético de
reacción [17].
2. MATERIALES Y MÉTODO
Las plumas para la
realización de ensayos fueron proporcionadas por el consorcio avícola Santa
Helena en Bogotá y utilizadas en su totalidad (raquis y barbillas). Las plumas fueron
lavadas con agua y alcohol, posteriormente secadas en horno a 40° C durante 24
horas, después de ello fueron molidas en un molino IKA-Universal Mühle
M20, el producto obtenido en la molienda fue tamizado en un tamiz de malla de 75
Micras y utilizado en su totalidad para realizar la hidrólisis. El
procedimiento seguido en los ensayos se describe en la figura 1.

Fig.1. Proceso para
realizar ensayos de hidrólisis.
La concentración de proteína
[mg/mL] hidrolizada fue determinada por el Método de Bradford [18]
, para la realización de la curva de calibración y posterior cuantificación de
proteína se empleó albumina de suero bovino (BSA) a diferentes diluciones, la
curva patrón se realizó para una longitud de onda de 595 nm y el coeficiente de
correlación (R2) obtenido alcanzó un valor de 0.99841. Es preciso
señalar que el método de Bradford permite determinar la presencia de proteína
en las muestras, y teniendo en cuenta que el 90% del contenido de las plumas
corresponde a queratina [12], es aceptable indicar que la proteína cuantificada
por el método de Bradford corresponde a queratina hidrolizada.
La identificación de
proteína hidrolizada obtenida en cada uno de los ensayos fue llevada a cabo
por la técnica de electroforesis en gel de poliacrilamida dodecilsulfato
de sodio (SDS-PAGE), esta técnica permite realizar la separación e
identificación de proteína [18]. Se llevó a cabo en la cámara de electroforesis
Mini-PROTEAN ®
Tetra cell, la diferencia de potencial aplicado para la corrida electroforética
fue de 25 Voltios y el tiempo empleado fue de 2.5 horas, la tinción de las
proteínas fue realizada con Azul brillante Coomasie R-250 y la decoloración se efectuó
con ácido acético y metanol diluido en agua destilada.
El diseño
experimental realizado fue factorial del tipo central compuesto con tres
réplicas del punto central [19], en el cual se estudió el
efecto de tres factores y dos niveles de cada uno, los factores fueron el pH (8
a 9), la temperatura (20 °C a 30 °C), y la dosis de enzima (0.03 g a 0.05 g). La
variable de respuesta seleccionada fue la concentración de proteína [mg/mL] en
el extracto y el número de ensayos realizado fue igual a 17, el análisis de los
resultados experimentales fue realizado con el software Design-Expert bajo
licencia, obteniendo un modelo de segundo orden que se analizó mediante un gráfico
de Pareto, un análisis de varianza (por sus siglas en inglés ANOVA), y una
gráfica de superficie de respuesta a fin de fijar interacciones entre las
variables y conocer la mejor combinación para la obtención de queratina
hidrolizada [19].
3.
RESULTADOS
La
influencia de cada una de las variables sobre la respuesta del sistema
analizado, se puede observar en el diagrama de Pareto el cual fue realizado en
el programa Minitab bajo licencia y que aparece en la figura 2
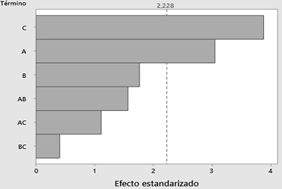
Fig.
2.
Diagrama Pareto de efectos estandarizados en la obtención de queratina
hidrolizada, factores:
A: pH, B: Dosis de enzima, y C: temperatura.
En la gráfica se
observa que la temperatura y el pH son las variables que afectan en mayor
medida la respuesta del sistema, seguido por la variable dosis de enzima y la
interacción de esta con el pH, de acuerdo a lo anterior, la superficie de
respuesta para la determinación de la máxima concentración de queratina
hidrolizada, se construirá exceptuando los efectos A2, B2
y C2.
Los resultados de concentración de proteína obtenida
en los ensayos por medio de la metodología superficie de respuesta (MSR) son
presentados en figura 3.
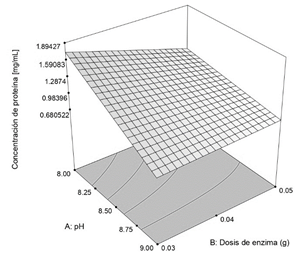
Fig. 3. Superficie de
respuesta, factores A: pH, B: Dosis de enzima, temperatura 25 ° C. variable de
respuesta concentración de proteína [mg/ml].
En la figura se
observa que la concentración de queratina hidrolizada tiende a ser mayor para
los ensayos realizados a pH levemente alcalino (pH 8) y bajas dosis de enzima Genencor®
Tan G plus, también se aprecia que a pH 9 la dosis de enzima no afecta de
manera significativa la cantidad de proteína hidrolizada obtenida, por otra
parte, la máxima concentración de proteína alcanzó un valor de 2.106 mg/mL a
una dosis de enzima Genencor® Tan G de 0.03 g, pH 8.0 y temperatura de 25°C.
La figura 4,
representa la superficie de respuesta para la concentración de proteína
hidrolizada contra el pH y la temperatura a dosis de enzima constante de 0.03
g.
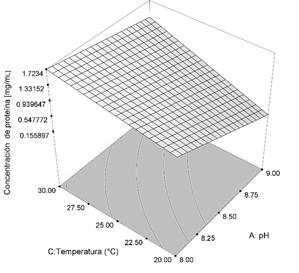
Fig. 4. Superficie de
respuesta, factores A: pH, B: C: Temperatura (°C), Dosis de enzima 0.03 g.
variable de respuesta concentración de proteína [mg/mL].
Se aprecia que a
medida que el pH de la solución aumenta la concentración de proteína disminuye,
por su parte al aumentar la temperatura aumenta la cantidad de proteína
obtenida, este efecto se aprecia en mayor proporción a pH 9. El resultado del
análisis de las dos superficies de respuesta permite confirmar lo expuesto en
el gráfico de Pareto y es que, para el rango de las variables analizadas, la
dosis de enzima es la variable que da lugar a las menores variaciones en la
cantidad de producto obtenido, lo que desde el punto de vista económico
representa una ventaja para el proceso, pues puede ser empleada la dosis más
baja de enzima para obtener la máxima cantidad de producto, variando dos
variables relativamente simples de controlar en un proceso, como son el pH y la
temperatura.
La tabla 1.
Corresponde al análisis de varianza de los resultados experimentales, a partir
del ANOVA se puede concluir que las variables o factores analizados dan lugar a
cambios en la variable de respuesta, que para el presente caso fue la
concentración de proteína hidrolizada en la solución obtenida.
A partir de los datos
de la tabla, se confirma que las variables más significativas o de mayor peso
para el proceso de hidrólisis enzimática son el pH y la temperatura, seguido
por la dosis de enzima aplicada dentro de los valores de los niveles
seleccionados de cada variable o factor analizado.
Tabla.
1. Análisis
de varianza (ANOVA) a partir de los resultados de Bradford de cada muestra.
|
Fuente de variación
|
Suma de Cuadrados
|
Grados de libertad
|
Cuadrados medios
|
Valor F
|
Prob>F
|
|
Modelo
|
3.19
|
9
|
0.35
|
3.35
|
0.0625
|
|
A:
pH
|
1.13
|
1
|
1.13
|
10.70
|
0.0137
|
|
B:
Dosis de enzima
|
0.27
|
1
|
0.27
|
2.55
|
0.1541
|
|
C:
Temperatura °C
|
1.33
|
1
|
1.33
|
12.57
|
0.0094
|
|
A2
|
0.039
|
1
|
0.039
|
0.36
|
0.5648
|
|
B2
|
0.074
|
1
|
0.074
|
0.70
|
0.4291
|
|
C2
|
2.179E-003
|
1
|
2.179E-003
|
0.021
|
0.8899
|
|
AB
|
0.21
|
1
|
0.21
|
2.01
|
0.1989
|
|
AC
|
0.11
|
1
|
0.11
|
1.02
|
0.3468
|
|
BC
|
0.014
|
1
|
0.014
|
0.13
|
0.7242
|
|
Residual
|
0.74
|
7
|
0.111
|
|
|
|
Falta
de Ajuste
|
0.74
|
3
|
0.25
|
266.97
|
<0.0001
|
|
Error
Puro
|
3.680E-003
|
4
|
9.200E-004
|
|
|
|
Total, corregido
|
3.93
|
16
|
|
|
|
|
|
|
|
|
|
3.1 Interacción de los
factores significativos sobre la variable de respuesta
El análisis de
interacción de las variables o factores permite analizar el efecto de estas sobre
la variable de respuesta, la figura 5 corresponde al gráfico de interacción de los
factores significativos.
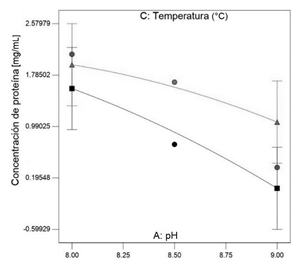
Fig. 5. Efecto de A: pH y C:
Temperatura °C sobre la concentración de proteína hidrolizada [mg/mL].
En
la figura 5 se observa que los factores significativos para el proceso A: pH y
C: Temperatura (°C) intervienen en la respuesta concentración de proteína
hidrolizada. Para temperaturas entre 20 °C hasta 30°C y pH 8.0 se tiene la
mejor condición de hidrólisis enzimática obteniendo mayor cantidad de proteína
hidrolizada.
3.2
Ecuación final en términos de factores reales:
A
partir de los datos experimentales se logró determinar la ecuación (2) con un
coeficiente de correlación R2 de 0.8074, correspondiente a la
superficie de respuesta presentada en las figuras 3 y 4.
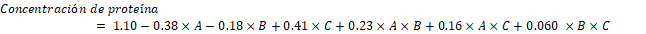
(2)
A= pH; B=Dosis de enzima; C=Temperatura.
A
partir de la ecuación 1, se determinan los valores de las variables que
permiten alcanzar la mayor concentración de proteína hidrolizada en el medio de
reacción, para esto fue empleado el software Design-Expert bajo
licencia. El resultado de la optimización señala que
a pH 8.0 y 25 ° C de temperatura, para una dosis de 0.03 g de enzima se alcanza
la máxima concentración de queratina hidrolizada en el producto.
3.3 Determinación del porcentaje de masa
El porcentaje de obtención
de proteína hidrolizada en cada uno de los ensayos fue determinado a partir de
la ecuación 3, la expresión matemática permite establecer dicho porcentaje a
partir de la concentración de proteína hidrolizada obtenida en la metodología
de Bradford, con base en el sustrato de plumas y el volumen de la mezcla
reactiva en cada ensayo.
 (3)
(3)
Aplicando
la ecuación anterior se determinó que el mayor porcentaje de masa obtenida para
la totalidad de los experimentos realizados alcanzó un valor del 8.42%, con una
concentración de plumas de 0.025 g/m L, una dosis de enzima de 0.03 g y a una
temperatura de 25°C.
3.4 Resultados de electroforesis
en gel de poliacrilamida dodecilsulfato de sodio (PAGE-SDS)
La electroforesis fue
realizada a las muestras con mayor concentración de proteína de acuerdo a los
resultados obtenidos en la metodología de Bradford, en estas se pudo observar
la tinción por la presencia de proteínas hidrolizadas resultantes del
tratamiento dado en cada ensayo. En la electroforesis se tomó como referencia el
marcador de peso de proteínas Opti-Protein XL Marker (~10kDa- ~245kDa) [20]. Se pudo encontrar
bandas correspondientes a los pesos moleculares de 35 kDa, 48 kDa y 50 kDa, las
dos últimas bandas mencionados se encuentran entre el rango de peso molecular
de la queratina, el cual varía entre 40 y 70 kDa [13].
4.
DISCUSIÓN
De
acuerdo a los resultados obtenidos en el diagrama de Pareto y el ANOVA,
la temperatura y el pH son factores significativos para la obtención de la proteína
hidrolizada (queratina) en presencia de la enzima proteolítica Genencor® Tan G plus; se
observó que los cambios de estas dos variables dan lugar a considerables
variaciones de la hidrólisis enzimática, resultados que concuerdan con los
obtenidos por E. Gaviria Acosta, R. Benítez y L. Lenis [21],
en este estudio se determinó que los cambios en el pH (siendo 7.2 el óptimo) del medio
de reacción dan lugar al cambio estructural de la proteína, por otra parte, el
incremento de la dosis de enzima no da lugar a cambios bruscos en el grado de
hidrólisis y por consiguiente en la cantidad de proteína encontrada.
Por tanto se puede
decir que el valor obtenido de proteína en el presente estudio (% de masa= 8.42%, con una
concentración de plumas de 0.025 g/mL y una dosis de enzima de 0.03 g) es comparable o
similar con la cantidad de proteína obtenida en la investigación realizada
por M. B. Valencia Andrade [12], en la que se obtuvo un 2.9% de queratina hidrolizada
con 0.04 g/mL de plumas y 0.075 g de enzima, en este trabajo fueron realizadas
pruebas previas con Sulfuro de Sodio y Metabisulfito de sodio a fin de realizar
una hidrólisis preliminar de la queratina y posteriormente llevar a cabo hidrólisis
enzimática de plumas.
De igual manera, en
la investigación realizada por G. Machuca Loja, B. Madrid Celi , D.
Sanmartin Galvan & J. Pérez Rodríguez
[3] se alcanzó un 65.75% de queratina hidrolizada con una
dosis de sustrato de plumas de 0.018 g/mL y 3 g de enzima, en este caso la relación
sustrato de plumas-enzima fue aquella que permitió alcanzar el mayor porcentaje
de queratina hidrolizada.
La electroforesis es
fundamental en la descripción de proteínas esto coincide con R. Benítez, A. Ibarz
y J. Pagan [22] donde afirman que un parámetro importante
para la hidrólisis de proteína es la distribución del peso molecular de los
péptidos en los hidrolizados, por lo cual se emplean técnicas como SDS-PAGE.
5. CONCLUSIONES
Con base en los resultados obtenidos se determina que el
mayor porcentaje de proteína hidrolizada conseguida alcanzó un valor de 2.106
mg/mL, equivalente al
8.42% de la masa inicial de sustrato (plumas), este valor se consiguió para pH
8, dosis de enzima 0.03 g y 25 °C de temperatura. A partir del diagrama de
Pareto y el diseño experimental analizado por MSR y el ANOVA, se estableció que
el pH y la temperatura son los factores que presentan la mayor influencia sobre
el rendimiento de queratina hidrolizada obtenida, seguido por la variable dosis
de enzima y la interacción de esta con el pH, de igual manera, que la reacción de hidrólisis enzimática se
favorece para pH ligeramente alcalino. La hidrólisis enzimática puede permitir
la valorización de los residuos de plumas de la industria avícola, esta
metodología se caracteriza por no ser agresiva con el medio ambiente, por tanto
en casos donde sea utilizada se evita la aparición de problemas adicionales a
los existentes por mala disposición de plumas.
La
electroforesis en gel SDS-PAGE, es una técnica efectiva para la determinación y
caracterización del peso molecular de queratina hidrolizada pero a su vez, es
una técnica muy sensible donde es esencial ser exactos en la preparación de los
geles, el tiempo de corrida y en la pureza de los reactivos.
El beneficio ambiental generado se fundamenta en el valor
agregado de las plumas de la industria avícola al realizar hidrólisis
enzimática, ya que el producto a obtener es queratina muy utilizada en la industria cosmética; influyendo
directamente en la disminución de las plumas como desechos, como residuo dispuesto para la quema o
alimento para animales, evitando de esta manera las afectaciones al medio
ambiente y a la salud de la población.
6. AGRADECIMIENTOS
A la empresa
MerQuiand S.A.S por el suministro de la enzima Genencor® Tan G plus utilizada
en cada uno de los ensayos, al consorcio avícola Santa Helena en Bogotá por el
suministro de las plumas, a María del Pilar Rodríguez por la ayuda en el desarrollo
de cada uno de los laboratorios, y a Yerson Amezquita
Sayo por su colaboración en el pre tratamiento de las plumas.
7.
REFERENCIAS BIBLIOGRÁFICAS
[1] A.
Brandelli , L. Sala y S. Juliano Kalil, .Microbial enzymes for bioconversion of
poultry waste into added-value products, Food Research International., 73,
3-12, 2015.
[2] N.
Reddy, “Non- food industrial aplications of poultry feathers,” Waste
Management., 45, 91-107, 2015.
[3] G. Machuca Loja,
B. Madrid Celi , D. Sanmartin Galvan y J. Pérez Rodríguez, Queratina a partir
de la hidrólisis enzimática de harina de plumas de pollo, utilizando
queratinasas producidas por Bacillus subtilis,UNEMI., 9, 50-58, 2016.
[4] DANE.Boletín
Técnico del Producto Interno Bruto. Departamento Admirativo Nacional de
Estadísticas, 2018.
[5] O.A. Ariza
Andrade, Estudio de Impacto Ambiental para una Granja de Engorde en el
Municipio de Fusagasugá. Disponible en: https://repository.unimilitar.edu.co/bitstream/handle/10654/16439/ArizaAndradeOscarAlirio2017.pdf;jsessionid=C015AED343CDA61294BA7DBC6FB05A8F?sequence=1 [Consultado el 30 de
enero de 2019].
[6] T.
Tesfaye, B. Sithole, D. Ramjugernath y V. Chunilall,.Valorisation of chicken
feathers: Characterisation of physical properties and morphological structure. Journal of Cleaner
Production., 149,349-365, 2017.
[7] M. V. Pérez Villa
y R. A. Villegas Calle, Procedimientos para el manejo de residuos orgánicos
avícolas.Universidad de Antioquia, 2009.
[8] C. R.
Holkar, S. S. Jain, A. J. Jadhav y D. V. Pinjari. Valorization of keratin based
waste. Process
Safety and Environmental Protetion., 115, 85-98, 2018.
[9] M. V. S. Cedilo.
Determinación de método para la obtención de queratina cosmética a partir de
plumas gallináceas. Universidad Central del Ecuador, 2013.
[10] G. Morales
Forqueras, A. F. Soria Tornazos, S. A. Salas Aguilar , M. Marca Lazarte, I.
Cardozo y X. Huaniquina Terrazas. Obtención de fibras de queratina a partir de
plumas de aves de corral para la elaboración de una crema para problemas
capilares,2011. Disponible en:
https://kupdf.net/download/perfil-obtencion-de-fibras-de-queratina-a-partir-de-plumas-de-aves-de-corral-para-la-elaboracion-de-una-crema-para-problemas-capilares_5cd42b89e2b6f5d3706c4d4c_pdf
[11] J. M. Orjuela
Palacio , M. C. Lanari Vila y N. E. Zaritzky, «Desarrollo de Productos a Base
de Queratina a Partir de residuos de la Industria Avícola,» III Jornadas de
Investigación, Transferencia y Extensión de la Facultad de Ingeniería, pp.
503-508, 2015.
[12] M. B. Valencia
Andrade. Obtención de Queratina a partir de plumas de la Industria Avícola
mediante Hidrólisis Enzimática. Universidad de las Américas, Quito, 2018.
[13] K. Chávez Marín. and C. Tenorio Hernández, Estudio para
la obtención de queratina a partir de plumas de pollo con los métodos de
sulfuro de sodio y borohidruro de sodio a nivel de laboratorio. Disponible
en:http://ribuni.uni.edu.ni/1473/. [Consultado el 5 de abril del 2018].
[14] Fichas de
seguridad de Sodio borohidruro. Disponible en:
https://www.carlroth.com/downloads/sdb/es/4/SDB_4051_ES_ES.pdf.
[15] Fichas de datos
de seguridad Sulfuro de Sodio.Disponibe en:
http://solkem.com.ar/wp-content/uploads/SULFURO-DE-SODIO-FDS.pdf.
[16] G. I. I. b.
Nature, Ficha técnica Genencor® Tan G, 2004. Disponible en: http://merquiand.com/es/quimico-especializado?id=73.
[17] G. J. Machuca
Loja. Obtención de queratina a partir de plumas de pollo utilizando
Queratinasas producidas por Bacillus spp. San Antonio de Machala, 2015.
[18] J. Hernandez
Fernandez, L. Ramirez Reyes, N. Ramires Hernandez y L. S. Fuentes Quintero,
«Caracterización Molecular,» de Métodos estandarizados para la caracterización
de cepas nativas de Bacillus thuringiensis para el control de insectos plaga:
modelo Tuta absoluta, Bogotá, Universidad de Bogotá Jorge Tadeo Lozano, 2012, pp.
31-38.
[19] H. Gutiérrez Pulido and R. Vara Salazar, Análisis
y diseño de experimentos. México
D.F.: McGraw-Hill, 2012.
[20]
Applied Biological Materials nc., “Opti-Protein XL Marker,”. Disponible en: https://www.abmgood.com/Protein-Marker-Bio-Rad.html [Consultado el 14 de
noviembre de 2018].
[21] E. Gaviria
Acosta, R. Benítez y L. Lenis, “Optimización de la hidrólisis enzimática de
proteínas presentes en semillas de guandul (Cajanus Cajan),” Biotecnología en
el Sector Agropecuario y Agroindustrial.,13, 114-122, 2015.
[22] R. Benítez, A.
Ibarz y J. Pagan. Hidrolizados de proteína: procesos y aplicaciones. Acta
Bioquímica Clínica Latinoamericana., 42, 36-227, 2008.
![]() (1)
(1)



