1. INTRODUCCIÓN
El yaque, Leiarius marmoratus Gill, 1870, es una especie eminentemente reofílica, que se encuentra por debajo de los 600 m.s.n.m,. principalmente en ríos meándricos de países tales como Colombia, Venezuela, Brasil, Perú y Bolivia. En Colombia se localiza específicamente en las cuencas de los ríos Orinoco y Amazonas [1]; pertenece a la familia Pimelodidae, orden Siluriformes, clase Actinopterígios, la revisión de Acosta-Santos et al., (2011) lo califica como omnívoro con tendencia carnívora (con los ítems de peces, camarones y algunas semillas como los de mayor frecuencia), con base en ejemplares provenientes de la cuenca del Amazonas [2]; mientras tanto, para ejemplares capturados en la cuenca del Orinoco, Ramírez-Gil y Ajiaco-Martínez (2011), reportan un espectro trófico mayor, en el que es más relevante la presencia de semillas y frutos que la de aquellos componentes de origen animal, en ese sentido, los autores prefieren calificarlo como omnívoro estricto, basando su conclusión también en el valor obtenido de la relación longitud intestinal/longitud estándar el cual fue de 1,6 [3]. Bajo otra interpretación, en la Orinoquia venezolana es considerada ictiófaga [4], esto dificulta el acercamiento a la precisión de sus hábitos alimenticos y por ende puede generar dificultades interpretativas. Por otra parte, la especie posee características que la clasifican como promisoria para la acuicultura: comparada su carne con la de otros bagres comerciales presenta mejor calidad nutricional [5], además de que acepta alimento balanceado en condiciones de cautiverio, característica relevante a la hora de elegir una especie para cultivo. Para L. marmoratus solo se reportan algunos aspectos básicos de la reproducción inducida en cautiverio [6], [7], manejo y alimentación inicial de larvas [8], [9] y de juveniles mantenidos en confinamiento suministrándoles concentrados comerciales formulados para otras especies con niveles de proteína bruta empíricos que varían entre el 24 y 36% [10]. y algunas experiencias de cultivo comercial [11], lo que ha permitido la producción de alevinos a pequeña escala. Sin embargo, la producción de esta especie a escala comercial es nula en la actualidad. Los avances en aspectos básicos sobre los requerimientos nutricionales en la especie se soportan solo en la categorización de su hábito alimenticio.
Un acercamiento hacia la capacidad que tienen los peces para utilizar variedad de nutrientes depende de la síntesis de enzimas digestivas apropiadas, en este sentido el perfil enzimático digestivo es un indicio para entender la ecología de la alimentación y los procesos digestivos [12]. La síntesis de tipos y niveles adecuados de enzimas digestivas está regulada por la disponibilidad de nutrientes, entre otros factores, que en el ambiente natural varía con el tiempo y, por lo tanto, ocurren cambios entre diferentes especies y poblaciones [13], por ejemplo, el hábitat donde se desarrollan los organismos acuáticos puede influir en la actividad de las proteasas [14]. Los peces son generalmente agrupados como herbívoros, carnívoros, detritívoros y omnívoros con relación a su hábito alimenticio, sin embargo, estas categorías se basan en la observación del contenido estomacal, metodología que no discrimina entre estrategias generalistas y oportunistas [15]. Bajo este contexto, el estudio de las enzimas digestivas puede ser útil para determinar qué tipo de nutriente contienen los alimentos que se consumen en medio natural, y esto a su vez sirve de línea base para posteriores estudios de requerimiento nutricionales en la especie. Por lo anterior el objetivo del presente trabajo fue cuantificar la actividad enzimática digestiva en adultos de L. marmoratus, obtenidos del medio natural.
2. MATERIALES Y METODO
2.1 Área de estudio
Los ejemplares fueron extraídos del río Meta, en el municipio de Cabuyaro (4°25′19.95”N -72°82′86.19”W) durante el período de agua bajas, por medio de calandrio (método de pesca pasivo utilizado por los pescadores de la zona, en el que se utiliza una línea principal de nylon, extendida a través de la corriente, de donde derivan líneas secundarias colgantes separadas por una distancia de 1 m y en su extremo libre llevan anzuelos), posteriormente fueron transportados vivos al Laboratorio Experimental de Alimentación y Nutrición de Peces del Instituto de Acuicultura de la Universidad de los Llanos , ubicado en el municipio de Villavicencio (4° 4’24.95"N -73°34’56.80"O), a 418 m.s.n.m., con una temperatura promedio anual de 25º C, donde fueron realizados los análisis de actividad enzimática.
2.2 Material biológico
Se registró para cada individuo el peso corporal que se determinó mediante una balanza electrónica de ± 1 g y la longitud total (desde la parte anterior de la cabeza hasta el punto posterior de la aleta caudal) utilizando un ictiómetro de ± 1 mm de precisión. El peso y longitud total promedio de los ejemplares analizados fue de 1037±164 g y 50±4 cm respectivamente. Posteriormente fueron sacrificados 13 ejemplares por sobredosis de metasulfonato de tricaina (MS-222®, 100 ppm), seguidamente se realizó un corte ventral, desde la altura del opérculo hasta el orificio anal, para extraer el tracto gastrointestinal; estómago, intestino anterior, medio y posterior fueron inmediatamente congelados individualmente en nitrógeno líquido y mantenidos a -20°C hasta los análisis bioquímicos.
2.3 Procesamiento de muestras
La muestra tomada para estómago e intestino fue de aproximadamente 100 mg, esta fue homogenizada en 1 ml de tampón de homogenización (fosfato de sodio monobásico 10 mM y tris 20 mM -pH 7,0 en glicerol 50% v/v) a 1000 rpm por 3 minutos a 4°C, utilizando un homogeneizador eléctrico de tejidos IKA T 10 Basic ULTRA-TURRAX®. Los homogenizados fueron centrifugados a 12000 rpm por 3 minutos a 4°C, utilizando centrífuga refrigerante 5424R Eppendorf®. Los sobrenadantes fueron empleados para cuantificar la actividad enzimática. Para cada una de las enzimas y cada parte del tracto digestivo se estandarizó la cantidad de homogenizado enzimático, pH y tiempo de reacción.
2.4 Actividad proteolítica total
Fue cuantificada utilizando el método de hidrólisis de caseína, adaptado por HIDALGO et al. (1999) [16]. Para la reacción enzimática se utilizó 0.2 M de glicina - HCl en buffer con pH 2.0, para estómago y 0.1 M de tris-HCl en buffer con pH 8.0, para intestino. La reacción enzimática estuvo constituida por 1% de caseína en agua (500 µL), buffer (480 µL), 20 μL de extracto enzimático. Posteriormente fue incubada a 25 ºC durante 40 minutos, la reacción fue interrumpida con 500 µL de TCA 20% (ácido tricloroacético), mantenido en hielo por 30 minutos y centrifugada a 12000 rpm por 4 minutos para la lectura del sobrenadante a una densidad óptica de 280 nm. Todas las muestras fueron realizadas por duplicado y paralelamente dos blancos, uno de enzima (donde la cantidad de enzima fue sustituida por agua desionizada) y otro de sustrato (donde el sustrato fue sustituido por agua desionizada), pasaron por los mismos procedimientos en los tubos de reacción. La tirosina fue utilizada como patrón, siendo una unidad de actividad enzima definida como la cantidad de enzima necesaria para catalizar la formación de 1μg de tirosina por 1 min (U). La actividad específica esta expresada en unidades por mg de proteína (U/mg proteína).
2.5 Actividad amilohidrolítica
Este ensayo fue realizado empleando el “kit” clínico Amilasa CNPG Liquiform (LABTEST®, Lagoa Santa, MG, Brasil). El principio del método se basa en la conversión de α-(2-cloro-4-nitrofenil)-β-1,4-galactopiranosilmaltosida (Gal-G2-α-CNP) por acción de la α- amilasa, liberando 2-cloro-4-nitrofenol y 1,4-galactopiranosilmaltosida. La reacción se mantuvo a 37°C y fue medida a 405 nm. La actividad específica esta expresada en µmol de glucosa hidrolizada por minuto por mg de proteína (U/mg proteína).
2.6 Actividades lipolíticas no específicas
Para estómago e intestino fueron determinadas según la metodología de ALBRO et al. (1985) [17], modificada por LUNDSTEDT et al. (2004) [18]. Las reacciones fueron incubadas a 25 °C por 60 minutos, una muestra de homogenizado enzimático (50 µL), 950 µL de sustrato ρ-nitrofenil miristato 0.4 mM, diluido en buffer amonio bicarbonato 24 mM (pH 7.8) y 0.5% de Triton X-100® (usado como emulsificante). La reacción se detuvo por adición de NaOH (25 mM) y la densidad óptica se registró a 405 nm. Una unidad enzimática (U) se definió como µmol de sustrato hidrolizado por minuto y se expresara por mg de proteína (U/mg proteína).
Para establecer las actividades específicas de cada enzima, las concentraciones de proteína total de los tejidos del tracto digestivo fueron determinadas por el método de BRADFORD (1976) [19]. Este método consiste en la mezcla de 10 µL de homogenizado enzimático, previamente diluido en tampón de homogenización para ajuste de la concentración, con el reactivo de Bradford Sigma-Aldrich (B6916)®. Posteriormente la reacción fue incubada a temperatura ambiente por 10 minutos y leída a 595 nm. La concentración de proteína fue calculada utilizando una solución estándar de albúmina de suero bovina (BSA) (1 mg/mL).
2.7 Tratamiento de los datos
Los datos de la actividad enzimática fueron procesados y descritos como media ± desviación estándar. Previo análisis de los resultados se efectuó la validación de los supuestos de normalidad y homogeneidad. Posteriormente, para determinar diferencias entre sesiones del tracto digestivo se aplicó análisis de varianza (ANOVA); en el caso de existir diferencias se utilizó la prueba de Tukey para comparar las medias entre las diferentes sesiones (estómago, intestino anterior, medio y posterior), como prueba a posteriori luego de establecer diferencias significativas. En todas las pruebas se estableció α = 0.05. La actividad relativa enzimática fue calculada así:
Donde Z es la suma de las medias de todos los tratamientos en una sección del tracto digestivo y ∑z es la suma de las medias de todos los tratamientos en todas las secciones del tracto digestivo. Para los análisis se utilizó el programa estadístico SPSS V.17.
3. RESULTADOS
A lo largo del tracto digestivo de Leiarius marmoratus se detectó hidrólisis de proteína, carbohidratos y lípidos, siendo mayor esta actividad a nivel de intestino anterior (Fig. 1).
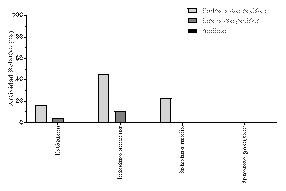 Fig.
1. Actividad enzimática relativa de proteasa inespecífica, lipasa inespecífica
y amilasa en estómago e intestino de Leiarius marmoratus en el medio
natural, expresada en porcentaje (%).
Fig.
1. Actividad enzimática relativa de proteasa inespecífica, lipasa inespecífica
y amilasa en estómago e intestino de Leiarius marmoratus en el medio
natural, expresada en porcentaje (%).
Esta especie presentó actividad proteolítica inespecífica ácida (estómago) y alcalina (intestino). La actividad específica de proteasa inespecífica en el estómago e intestino medio fue significativamente (P˂0,05) menor con relación a la actividad del intestino anterior. La actividad específica para este enzima fue de 34,3 ± 7,7 U/mg de proteína para la sección del intestino anterior. La actividad más baja se observó a nivel del estómago y fue de 11,8 ±4,1 U/mg de proteína (Fig. 2).

Fig. 2. Actividad proteolítica inespecífica ácida y alcalina en el estómago e intestino de L. marmoratus en el medio natural. Letras diferentes representan diferencias significativas entre secciones del tracto digestivo (P ˂0,05); los valores se expresan como la media ± DE (n=13). U=µg/minuto.
La actividad lipolítica en L. marmoratus se observó en estómago, intestino anterior y medio, siendo menor para este último. La actividad de lipasa fue significativamente (P˂0,05) mayor a nivel del intestino anterior (8,5±2,1 U/mg de proteína) y significativamente menor a nivel del intestino medio (0,033±0,0 U/mg de proteína) (Fig. 3).

Fig. 3. Actividad lipolítica inespecífica en el estómago e intestino de L. marmoratus en el medio natural. Letras diferentes representan diferencias significativas entre secciones del tracto digestivo (P ˂0,05); los valores se expresan como la media ± DE (n=13). U=µmol/minuto.
La actividad de amilasa se detectó a nivel de estómago, intestino anterior y medio. Sin embargo, esta actividad fue superior en el intestino anterior. En esta sección, la actividad de la amilasa fue de 0,36±0,07 U/mg de proteína. A nivel del estómago la actividad amilohidrolítica fue 0,23±0,05 U/mg de proteína (Fig. 4).
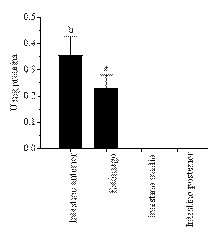
Figura 4. Actividad amilohidrolítica en estómago e intestino de Leiarius marmoratus en el medio natural. Letras diferentes representan diferencias significativas entre secciones del tracto digestivo (P ˂0,05); los valores se expresan como la media ± DE (n=13). U=µmol/minuto.
4. DISCUSIÓN
La capacidad de los peces para convertir y utilizar los nutrientes de la dieta depende de la producción de enzimas digestivas, su calidad y distribución en el tracto gastrointestinal [20]. El tracto digestivo es un sistema de órganos que es afectado por cambios en la ingestión de nutrientes [21], ya que el origen, el tipo y la cantidad de estos pueden alterar el perfil enzimático digestivo de los peces [22]. En este contexto algunos estudios muestran que los peces presentan capacidad de modular su perfil digestivo frente a diferentes recursos alimenticos [23], tipos de nutrientes [24] y niveles de nutrientes [22] de la dieta. Sin embargo, recientemente se han reportado algunos datos acerca de los componentes de la dieta y su efecto en las adaptaciones digestivas en teleósteos de agua dulce [18], [25]. Hernandez-Sámano et al. (2017) sugieren que no solo el alimento sino también la calidad del agua puede llegar a influir en la actividad enzimática puesto que hallaron la presencia de proteasas con máxima actividad en pH alcalino para Cyprimus carpio, lo que hasta el momento no se había reportado en esta especie acuática, por lo tanto, sugirieron que los resultados obtenidos estaban relacionados con la adaptación de la especie a aguas contaminadas con pH alto [26].
En el presente estudio, fue detectada hidrólisis de proteína, carbohidratos y lípidos a lo largo del tracto digestivo de Leiarius marmoratus (Fig. 1), observándose mayor actividad enzimática a nivel del intestino anterior, este resultado es compatible con la flexibilidad morfológica y fisiológica digestiva de las especies omnívoras [27]. En los ejemplares de L. marmoratus evaluados, no se detectó actividad enzimática digestiva en el intestino posterior, coincidiendo con lo reportado por otros autores para especies como Pseudoplatystoma corruscans, Colossoma macropomum y Piaractus mesopotamicus [25], [18], [28]. Según Tengjaroenkul et al. (2000), la baja o nula actividad enzimática en el intestino posterior de los peces es atribuida a la función de reabsorción de esta porción del tracto, demostrando un papel secundario en la producción de enzimas [29].
Las proteínas tienen un papel importante en la reproducción, en el desarrollo y en el crecimiento de todos los animales; para digerir las proteínas ingeridas en la dieta los órganos digestivos secretan proteasas ácidas y alcalinas [30]. En la digestión proteica, grandes polipéptidos son hidrólizados por la pepsina del estómago, seguido por la acción de las endopeptidasas y exopeptidasas que degradan la cadena polipeptídica en aminoácidos, que luego son absorbidos por el torrente sanguíneo [31]. En el presente estudio, L. marmoratus mostró actividad proteolítica inespecífica ácida (estómago) y alcalina (intestino). La actividad específica de proteasa inespecífica en el estómago e intestino medio fue significativamente (P˂0.05) menor con relación a la actividad del intestino anterior. La actividad específica para esta enzima fue de 34.3 ± 7.7 U/mg de proteína para la sección del intestino anterior. La actividad más baja se observó a nivel del estómago y fue de 11.8 ±4.1 U/mg de proteína (Figura 2). Lo que sugiere que estas dos porciones del tracto digestivo son las encargadas de la digestión de las proteínas en esta especie. CHONG et al. (2002) reporta para disco Symphysodon aequifasciata actividad de proteasa en la región acida del estómago y en la región alcalina del intestino [32], resultados similares fueron reportados por De ALMEIDA et al. (2010) para juveniles de tambaqui Colossoma macropomum [33]. En juveniles de Centropomus parallelus la actividad de proteasas ácidas fue mayor (64,75±5,23 U/mg de proteína) a las proteasas alcalinas (0,019±0,005 U/mg de proteína) [34], por lo tanto, los autores concluyeron que esta especie se puede considerar carnívoro estricto y comprueban que en el estómago es donde se realiza la mayor parte de la hidrólisis, estos resultados son inversos a lo hallado en L. marmoratus, el cual presentó menor actividad proteómica en el estómago que en el intestino.
La actividad lipolítica en L. marmoratus se observó en estómago, intestino anterior y medio, siendo menor para este último (Fig. 3). La distribución de esta enzima varía entre especies, para C. macropomum reportan actividad lipolítica en estómago e intestino anterior [33], en Sparus aurata es mayor en los ciegos pilóricos y en el intestino que en el estómago, donde esta actividad es escasa [35]. En Dentex dentex la actividad de lipasa no fue detectada en el estómago y los mayores valores fueron encontrados en los ciegos pilóricos [36]. En especies como Dentex dentex [36] y en C. macropomum [33], la lipasa es modulada por el contenido de lípidos en la dieta. Cuando los niveles de lípidos en la dieta están por encima de los requisitos metabólicos, podría ser almacenado como grasa visceral. Dietas con altos valores de lípidos pueden afectar la actividad de la lipasa, los niveles de colesterol y triglicéridos y causar disminución del crecimiento [10].
La digestión de carbohidratos es realizada en el intestino por una variedad de enzimas. La más común es la amilasa, producida por el páncreas [37]. La actividad de amilasa se detectó a nivel de estómago, intestino anterior y medio. Sin embargo, esta actividad fue superior en el intestino anterior. En esta sección, la actividad de la amilasa fue de 0.356±0.07 U/mg de proteína. A nivel del estómago la actividad amilohidrolítica fue 0.231±0.05 U/mg de proteína (Fig. 4), esto es un indicativo de que la especie tiene capacidad de digerir almidón. Esto ha sido observado en varias especies de peces, carnívoros y omnívoros, principalmente de agua dulce [18], [25]. La actividad amilohidrolítica en L. marmoratus permite afirmar que la digestión del almidón es más eficiente en el intestino que en el estómago. Para matrinxa e híbridos de pintado la activada es mayor en ciegos pilóricos e intestino anterior [38].
Considerando que la regulación de la actividad enzimática digestiva es compleja y que funciona simultáneamente en varios niveles, por la regulación de la transcripción, la traducción, entre otras [39] la comparación de la actividad entre los diferentes estudios y especies es compleja [33]. Esto se debe a que existen discrepancias en las técnicas analíticas utilizadas para la determinación de estas, en los diferentes hábitos alimenticios de las especies y en la composición de las dietas consumidas.
En la Orinoquia colombiana además de los cambios biológicos, los peces se enfrentan a unos cambios estacionales extremos, lo que puede variar la disponibilidad de nutrientes y a su vez modular los perfiles de enzimas digestivas. KUZ'MINA (1996) [40] demostró que la actividad enzimática digestiva puede estar altamente correlacionada con la dieta, encontrando que algunas enzimas digestivas de 37 especies de peces estaban relacionadas con la composición de los alimentos y la actividad alimentaria. Este autor afirma que las enzimas digestivas sirven como indicadores efectivos de la ecología trófica de los peces.
5. CONCLUSIONES
Este trabajo es un acercamiento al conocimiento de aspectos básicos de fisiología digestiva de L. marmoratus en el medio natural, que sirve como punto de partida para futuras investigaciones en la línea de nutrición de la especie. Por otra parte, es necesario complementar este tipo de investigaciones con la medición de otras variables que puedan estar afectando la actividad enzimática de la especie como: disponibilidad de alimento, estacionalidad climática, sexo, etapa fisiológica, entre otras, además de profundizar en la capacidad de la especie para modular su actividad enzimática. Por último, se confirma que la especie se puede identificar con hábitos más de tipo omnívoro que carnívoro, ya que se observa mayor actividad enzimática en la fase de digestión intestinal.
6. AGRADECIMIENTOS
A la Dirección General de Investigaciones de la Universidad de los Llanos por el soporte financiera del proyecto código CAIALL-1-2013 “Aspectos morfológicos y perfil enzimático del sistema digestivo del yaque, Leiarius marmoratus y su relación con los hábitos de alimento en ambiente natural”, el cual dio bases para el desarrollo de la Tesis de Doctorado en Ciencias Agrarias- Línea Acuicultura: “Requerimientos de proteína lípidos y carbohidratos de juveniles de yaque, Leiarius marmoratus, Gill 1870”.
7. Referencias Bibliográficas
[1] Maldonado-Ocampo, J.A., Vari, R.P. y Usma, J.S. Checklist of the freshwater fishes of Colombia. Biota Colombiana, 9(2), 143-237, 2008.
[2] Acosta-Santos, A., Agudelo-Córdoba, E., Ajíaco-Martínez, R. y Ramírez-Gil, H. Leiarius marmoratus (Gill 1870). Ficha Amazonas. En: Catálogo de recursos pesqueros continentales de Colombia (Eds Lasso, C., Agudelo- Córdoba, E., Ramírez-Gil, H., Morales-Betancourt, M., Ajiaco-Martínez, R., Gutiérrez, F., Usma- Oviedo, J.S., Muñoz-Torres, S. y Sanabria-Ochoa, A.), Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt. 448-45, 2011.
[3] Ramírez-Gil, H. y Ajíaco-Martínez, R. Leiarius marmoratus (Gill 1870). Ficha Orinoco. En: Catálogo de recursos pesqueros continentales de Colombia (Eds Lasso, C., Agudelo- Córdoba, E., Ramírez-Gil, H., Morales-Betancourt, M., Ajiaco-Martínez, R., Gutiérrez, F., Usma- Oviedo, J.S., Muñoz-Torres, S. & Sanabria-Ochoa, A.), Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt, 451-454, 2011
[4] Layman, C.A., Winemiller, K.O., Arrington, D.A., y Jepsen, D.B. Body size and trophic position in a diverse tropical food web. Ecology, 86 (9): 2530-2535, 2005.
[5] Cruz-Casallas, N.E., Medina-Robles, V.M., Cruz-Casallas, P.E. y Suárez-Mahecha, H. Nutritional characterisation of filetes of bagre yaque (Leiarius marmoratus) pertinent of natural extraction and crop. Orinoquia, 16: 259-259, 2012.
[6] Kossowski, C. Observaciones preliminares sobre reproducción inducida y ontogénesis temprana del bagre negro, Leiarius marmoratus (Piscis, Siluriformes). Memorias XXVI Convención Anual AsoVAC. AsoVAC- Universidad de Carabobo. Valencia (Edo. Carabobo), Venezuela. 232, noviembre 1986.
[7] Escobar, L., y Mojica, H.O. Ensayos preliminares de reproducción inducida del yaque, Leiarius marmoratus (Gill, 1870) (Pisces: Siluriformes:Pimelodiade) en la Orinoquía colombiana. Bol. Cien. INPA, 5, 9-26, 1997.
[8] Marciales-Caro, L.J., Cruz-Casallas, N.E., Díaz-Olarte, J.J., Medina-Robles, V. M., y Cruz-Casallas, P.E. Crecimiento y sobrevivencia de post-larvas de bagre rayado (Pseudoplatystoma sp.) y yaque (Leiarius marmoratus) consumiendo una dieta seca. Revista Colombiana de Ciencias Pecuarias, 24(2), 179-190, 2011.
[9] Ramírez-Merlano, J.A., Otero-Paternina, A.M., Corredor-Santamaría, W., Medina-Robles, V.M., Cruz-Casallas, P.E., y Velasco-Santamaría, Y.M. Utilización de organismos vivos como primera alimentación de larvas de yaque (Leiarius marmoratus) bajo condiciones de laboratorio. Revista Orinoquia, 14(1), 45-58, 2010.
[10] Gutiérrez-Espinosa, M. C., Velasco-Garzón, J. S., y León-Morales, C. A. Revisión: necesidades nutricionales de peces de la familia Pimelodidae en Sudamérica (Teleostei:Siluriformes). Revista de Biología Tropical, 67(1), 146-163, 2019
[11] Sánchez, J. A. M., Moyetones, F. y Cerdá, M.J. Influencia del contenido proteico en el crecimiento de alevines de bagre yaque, Leiarius marmoratus, alimentados con concentrados comerciales. Zootecnia Tropic, 27, 187-194, 2009.
[12] Gupta, S.S. y Homechoudhury, S. Comparison of trophic niche and digestive enzymes of four species of catfishes of the Punarbhaba River in India. Indian Journal of Fisheries, 58 (4), 79-85, 2011.
[13] López-Vásquez, C.A. y Castro-Pérez, A.L. Digestive enzymes of eight Amazonian teleosts with different feeding habits. Journal of Fish Biology, 74, 1620-1628, 2009.
[14] Fu, X., Xue, C., Miao, B., Li, Z., Gao, X., y Hirata, T. Distribution and seasonal activity variation of proteases in digestive tract of sea cucumber Stichopus japonicus. Fisheries Science, 72, 1130-1132, 2006.
[15] Braga, L. Primeros registros para la Argentina de tres especies de la familia Rivulidae (Teleostei, Cyprinodontiformes). Physis, B, Buenos Aires, Argentina, 57(132-133), 11-15, 1999.
[16] Hidalgo, M.C., Urea, E. y Sanz, A. Comparative study of digestive enzymes in fish with different nutritional habits. Proteolytic and amylase activities. Aquaculture, 170, 267-283, 1999.
[17] Albro, P.W., Hall, R.D., Corbett, J.T. y Schroeder, J. Activation of nonspecific lipase (EC 3.1. 1.-) by bile salts. Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism 835(3), 477-490, 1985.
[18] Lundstedt, L.M., Melo, J. y Moraes, G. Digestive enzymes and metabolic profile of Pseudoplatystoma corruscans (Teleostei: Siluriformes) in response to diet composition. Comparative Biochemistry and Physiology Part B, 137, 331–339, 2004.
[19] Bradford, M.M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72: 248-254, 1976.
[20] González-Zamorano, M., Navarrete Del Toro, M. A. y García-Carreño, F. L. Exogenous proteinases as feed supplement for shrimp: in vitro evaluation. Aquaculture Nutrition, 19, 731-740, 2013.
[21] Hakim, Y., Harpaz, S. y Uni, Z. Expression of brush border enzymes and transporters in the intestine of European sea bass (Dicentrarchus labrax) following food deprivation. Aquaculture, 290(1), 110-115, 2009.
[22] Debnath, D., Pa, A.K., Sahu, N.P., Yengkokpam, S., Baruah, K., Choudhury, D. y Venkateshwarlu, G. Digestive enzymes and metabolic profile of Labeo rohita fingerlings fed diets with different crude protein levels. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 146(1),107-114, 2007.
[23] El-Sayed, A. F., Nmartinez, I. y Moyano, F.J. Assessment of the effect of plant inhibitors on digestive proteases of nile tilapia using in vitro assays. Aquaculture International, 8(5), 403-415, 2000.
[24] German, D.P., Horn, M.H. y Gawlicka, A. Digestive enzyme activities in herbivorous and carnivorous prickleback fishes (Teleostei: Stichaeidae): ontogenetic, dietary, and phylogenetic effects. Physiological and Biochemical Zoology, 77(5), 789-804, 2004.
[25] De Almeida, L.C., Lundstedt, L.M. y Moraes, G. Digestive enzyme responses of tambaqui (Colossoma macropomum) fed on different levels of protein and lipid. Aquaculture Nutrition, 12(6), 443-450, 2006.
[26] Hernandez-Sámano, A.C., Guzman-García, X., Garcia-Barrientos, R. y Guerrero-Legarreta, I. Actividad enzimática de proteasas de Cyprinus carpio (Cypriniformes: Cyprinidae) extraídas de una laguna contaminada en México. Rev. Biol. Trop., 65 (2), 589-597, 2017.
[27] Hakim, Y., Uni, Z., Hulata, G. y Harpaz, S. Relationship between intestinal brush border enzymatic activity and growth rate in tilapias fed diets containing 30% or 48% protein. Aquaculture 257(1), 420-428, 2006.
[28] Moraes, G. y Bidinotto, P.M. Induced changes in the amylohrydrolytic profile of the gut of Piaractus mesopotamicus (Holmberg, 1885) fed different levels of soluble carbohydrate: its correlation with metabolic aspects. Revista de ictiologia, 8, 47-51, 2000.
[29] Tengjaroenkul, B., Smith, B. J., Caceci, T. y Smith, S. A. Distribution of intestinal enzyme activities along the intestinal tract of cultured Nile tilapia, Oreochromis niloticus L. Aquaculture, 182(3), 317-327, 2000.
[30] Liu, Z.Y., Wang, Z. y Zhang, J. An acidic protease from the grass carp intestine (Ctenopharyngodon idellus). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 149(1), 83-90, 2008.
[31] Natalia, Y., Hashim, R., Ali, A. y Chong, A. Characterization of digestive enzymes in a carnivorous ornamental fish, the Asian bony tongue Scleropages formosus (Osteoglossidae). Aquaculture, 233(1), 305-320, 2004.
[32] Chong, A.S., Hashim, R., Chow-Yang, L., y Ali, A.B. Partial characterization and activities of proteases from the digestive tract of discus fish (Symphysodon aequifasciata). Aquaculture, 203(3), 321-333, 2002.
[33] De Almeida, L. D. Desempenho produtivo, eficiência digestiva e perfil metabólico de juvenis de tambaqui, Colossoma macropomum (Cuvier, 1808) alimentados com diferentes taxas carboidrato/lipídio [Teses doutorado] Universidade Federal de São Carlos. São Carlos-SP, Brasil, 2010.
[34] Jesús-Ramirez, F., Álvarez-González, C.A., Nolasco-Soria, H.G., Peña, E., Martínez-García, R., Camarillo-Coop, S., Conway, K. y Pohlenz, C. Caracterización parcial de proteasas digestivas del chucumite (Centropomus parallelus). Hidrobiológica 27(3), 419-427, 2017
[35] Eroldoğan, O.T., Suzer, C., Taşbozan, O. y Tabakoğlu, S. The effects of rate-restricted feeding regimes in cycles on digestive enzymes of gilthead sea-bream, Sparus aurata. Turkish Journal of Fisheries and Aquatic Sciences, 8(1), 49-54, 2008.
[36] Pérez-Jiménez, A., Cardenete, G., Morales, A. E., García-Alcázar, A., Abellán, E. y Hidalgo, M.C. Digestive enzymatic profile of Dentex dentex and response to different dietary formulations. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 154(1), 157-164, 2009.
[37] Lovell, T. Nutrition and feeding of fish. New YorK, NY: Van Nostrand Reinhold, 1988.
[38] Yamakami, R. Efeitos de carboidratos no desempenho, na digestao e no metabolismo de matrinxa (Brycon amazonicus) e hibridos de pintado (Pseudoplatystoma corruscans x Pseudoplatystoma fasciatum) em um periodo curto de alimentacao.: [Teses doutorado] Universidade Federal de São Carlos. São Carlos-SP. 2012.
[39] Sunde, J. Digestive protease activities, growth and feed utilisation in Atlantic salmon (Salmo salar L.): Tesis (Doctor Scientiarium) - Institute of Marine Research (IMR)-Department of Aquaculture, University of Bergen, Bergen, Norway, 2006.
[40] Kuz'mina, V.V. Influence of age on digestive enzyme activity in some freshwater teleosts. Aquaculture 148(1), 25-37, 1996.